インターフェロンのシグナルダイナミズムとその生体防御系における調節作用
相互に関与しあうⅠ型とⅡ型のインターフェロン
インターフェロンは,生体防御に作用しているタンパク質である。 しかし,その効果についての分子メカニズムはまだ十分に解明されていない。 谷口維紹教授の研究室では,インターフェロンの産生やシグナル伝達の解析を行っており,なかでも私は,特にインターフェロンの生体防御システムのメカニズムを解析し,その役割を明らかにすることを目的としている。
インターフェロンには大きく分けてⅠ型(IFN-α/β)とⅡ型(IFN-γ)の2種類が存在する。 なかでもIFN-α/βは,すでに感染症やガン,自己免疫疾患における臨床応用がもっとも進んでいることでも知られる。 IFN-α/βとIFN-γは,それぞれ受容体は異なるものの,いずれも細胞膜にシグナルが伝わることにより,さまざまな遺伝子が発現するシグナル伝達を行う。 ウイルスによる感染症などに対する免疫応答系において,IFN-α/βの受容体 はIFNAR-1とIFNAR-2,IFN-γの受容体はIFNGR-1とIFNGR-2の各々2つのサブユニットから構成されていることが知られている。 これまで,それぞれの伝達のメカニズムは独立したものと考えられてきたが,最近の研究で,相互に影響を与えあっている(クロストーク)ことが分かってきた。 IFNAR-1欠損マウス細胞を使ったIFN-γによる応答性を,抗ウイルス活性で検討した結果,野生型マウス細胞に比べ,IFN-γの活性が低下した。 また,IFN-βを欠損した細胞でも,IFN-γの活性は弱くなった。 つまり,Ⅰ型のIFNからⅡ型のIFNに対し,シグナル増強をもたらす,構成的な調節機構が存在していると考えられる。
また,別の実験では,従来,ウイルス感染細胞でだけ産生されると考えられていたインターフェロンが,正常細胞においても微量に産生されていることが分かり,さらにはⅠ型だけが誘導されていた。 これは,生体防御系のシグナル伝達が常に増幅していることを示し,ウイルスとの反応により増強するのである。 こうした現象は,車のエンジンにたとえると分かりやすい。 車を急発進させる時,エンジンを普通に回転させているだけの場合と,エンジンをふかしている状態からの発進では,後者の状態からのほうが早く発進できる。 そのため,私たちはこのインターフェロンの微量産生モデルをレビングアップ(Revving-up)モデルと呼んでいる。 このように弱いシグナルが強いシグナルをダイナミックに調節している機構は特に自然免疫システムをはじめとする迅速でかつ強力なシグナルを必要とする生体防御系において重要な役割を担っていると考えられる。
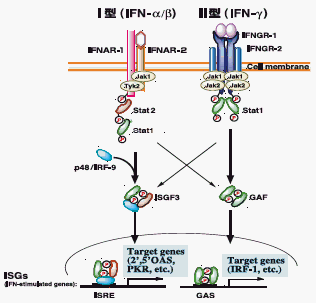
図:Ⅰ型(IFN-α/β)およびⅡ型(IFN-γ)インターフェロンによるシグナル伝達経路
インターフェロンとp53の関連も判明
また,抗腫瘍作用においても発見があった。 ガン抑制因子として知られるp53タンパク質とインターフェロンの関連性である。 p53はアポトーシスを誘導するタンパク質であり,p53に異常があると,発ガンの可能性が飛躍的に高まる。 ガン細胞を用いた実験では,細胞をIFN-α/βで刺激させたとき,細胞内のp53タンパク質の発現レベルが上昇した。 この発現誘導は,従来から知られていたタンパク質の修飾によるものではなく,ISGF3を介した誘導であることも分かった。 ただし,IFN-α/βはp53タンパク質の発現には関与するものの,p53の活性化には関与しない。
しかし,その後の研究において,IFN-βによってp53を誘導させることが,抗ガン剤やX線照射によるガン細胞のアポトーシスであるp53応答の増強に関与していることが明らかになってきた。 これらの研究結果は,谷口教授のご指導の下,多くの研究者の協力によって得られたものであり,深く感謝している。 さらに研究を進めていくことで,脳腫瘍や腎ガン,肝ガンなどの臨床応用におけるインターフェロン作用のメカニズム解明にも役立つと考えられる。 そうすれば,副作用の少ない併用療法の発見につながる可能性もあるだろう。
こうしたインターフェロンのメカニズム解析は,抗ウイルス作用,抗腫瘍作用,免疫調節作用といった,現在行われているシグナル伝達に関する研究領域のほぼ全域にまたがることもあり,今後のさまざまな研究に役立つと考えている。 さらにインターフェロン系を調節するIRF転写因子の生体防御系における役割についても研究を進めている。