HOME >> 研究内容
研究課題:免疫機能の制御メカニズム解明と感染症・がん・アレルギー・免疫関連疾患治療への応用
研究概要:
私たちの健康維持にとって重要な免疫系は、通常様々な免疫担当細胞群が互いに協力し合い、外来由来の異物、病原微生物、あるいはウイルス感染細胞やがん細胞など自己にとって好ましくない細胞を排除しています。しかしながら、これらの免疫機能が破綻すると、重篤な感染症、自己免疫疾患やアレルギー疾患、がんの発生等に至ることが知られています。そこで免疫機能学分野においては、免疫調節の中枢を担う樹状細胞とヘルパーT細胞を基軸とした免疫機能の制御メカニズムを解明して、感染症、がん、アレルギー、自己免疫病などの免疫関連疾患に対する新しい免疫療法を開発することを目的として研究を実施しています。さらに、これまで得られた基盤的研究成果をもとに、北海道大学病院・大学院医学研究科と連携したトランスレーショナルリサーチも展開しています。本研究の成果によって、地域社会に密着した新しい医療バイオ研究の発展に貢献することを目標としています。
研究内容:
樹状細胞の機能制御機構の解明と感染症・がん・アレルギー性疾患治療への応用
樹状細胞は代表的な抗原提示細胞で我々の免疫調節の中枢を担う重要な免疫担当細胞の一つです。本研究室では樹状細胞による抗原特異的ヘルパー・キラーT細胞の活性化を基軸とした免疫機能の制御メカニズム解明を行なうとともに、ウイルスや細菌による感染症、がんやアレルギーなど免疫関連疾患について、より効果の高い新しい治療法の開発を展開しています。本研究に関わるテーマとして、(a)樹状細胞の抗原提示機能の制御による効率的がん特異的T細胞誘導法の開発とそのがん治療への応用;(b)感染やアレルギーなど慢性・炎症性疾患におけるタキキニン類・ニューロキニンA(NKA)とその受容体(NK2R)の発現誘導を介した神経ペプチドシグナルの活性化による新しいがん・免疫機能の制御メカニズム解明; (c)がんの悪性化の起点となる神経免疫コンダクター細胞を標的とした次世代型がん免疫療法の開発などがあります。
特にヒトの免疫機能の解明については、北海道大学病院および大学院医学研究院と連携して臨床検体を用いた解析・評価を行い、免疫治療の有効性の検証とその機序解明に関する研究を実施しています。
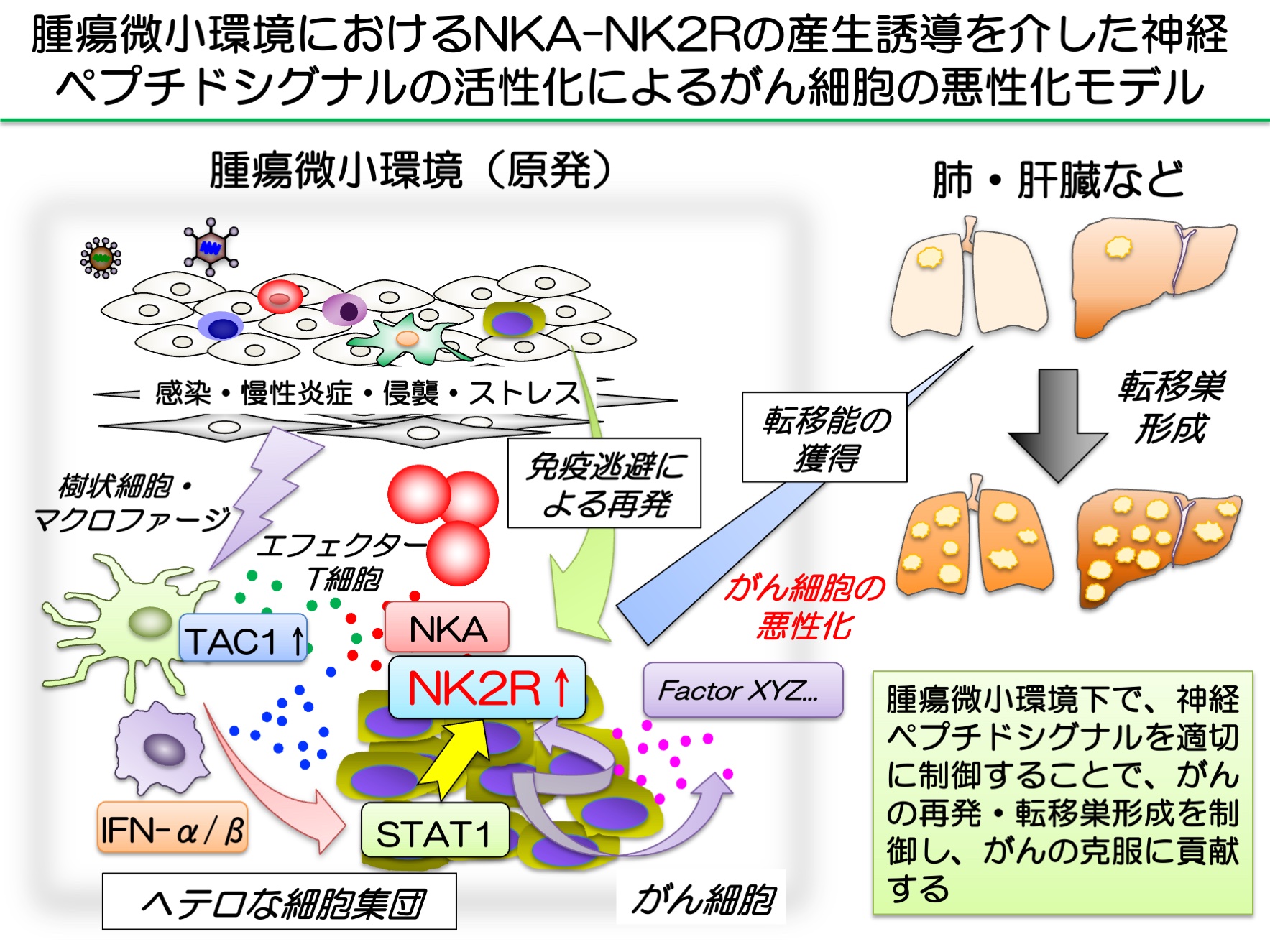
図1. 担がん生体におけるニューロキニンA(NKA)およびその受容体(NK2R)の産生誘導を介した神経ペプチドシグナル の活性化によるがん細胞の転移能獲得メカニズム
ウイルス・細菌感染、慢性炎症、侵襲やストレスによって樹状細胞やマクロファージにより産生されるNKAやがん細胞に誘導されるNK2Rを介した神経ペプチドシグナルの遮断によりがん細胞転移能獲得などの悪性化が阻害されることでがんの制御が期待できると考えられる。
マイクロRNAを基軸とした免疫体質の解析・評価に関する研究
樹状細胞およびT細胞を介した宿主免疫体質の破綻は、がん、アレルギー、感染症など様々な病気の発症の原因となると考えられています。現在、治療効果の高い、安心・安全なワクチン、がん免疫治療の開発には、治療前および治療過程における、被験者の免疫状態を評価する免疫モニタリング法の開発や、臨床効果を予見し得るバイオバーカーの探索と同定が望まれています。
そこで私たちは、被験者個々の免疫体質を予め判定できる標準化された血清マイクロRNAを基軸としたバイオマーカー・評価法の確立とその免疫調節機能の作用機序解明を行なっています。本研究で得られた情報をデータベース化することで、個々の患者の治療前の早期の段階で治療効果を予見すること、重篤な副作用の発生を未然に防ぐ個別化治療システムの構築を目指しています。また本研究成果を活用し、食による免疫体質の改善、インフルエンザやコロナウイルスなどの感染症やHPV、HCVあるいはピロリ菌の感染が起因となって発生する感染がんにおけるワクチン治療の効果や副作用の予見とともに、さらに現代日本社会でも大きな問題になっている食物アレルギー、花粉症、アトピー、アナフィラキシー、喘息などの過剰な免疫・アレルギー応答性に関するリスクの予測に関する研究も行ない、安心・安全な個別化医療の実現を目指しています。
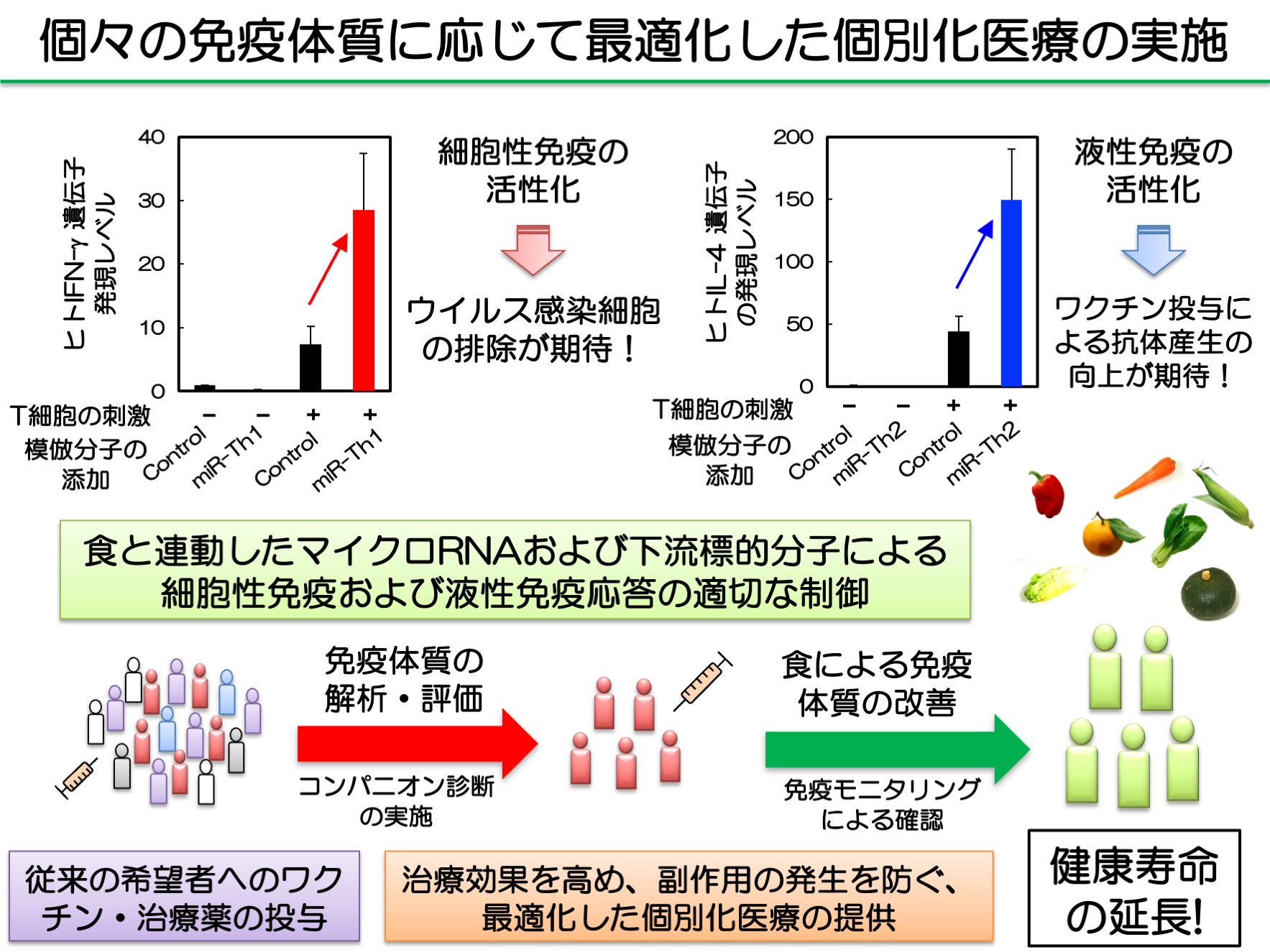
図2. 免疫体質の改善による安心・安全なワクチン投与、治療の実施
私たち一人一人の免疫体質について解析、評価し、副作用の発生を未然に防ぐとともに、個々の免疫体質を適切に改善し、ワクチン投与による予防効果や治療効果を高めることで、安心・安全な個別化医療の実現が期待できると考えられる。
がん・慢性炎症時に産生されるIL-6を介した樹状細胞の機能不全の解明
がんは医学の進歩により生命予後の著しい改善がなされてきましたが、依然として日本人の死亡原因の一位です。そこで、現在、既存の標準治療法に加え、がん免疫治療の研究開発がなされているが、未だ標準的な治療法までには至っていません。これは、がん患者生体内での免疫状態の低下を要因とする、抗腫瘍免疫の不良が原因の一つと考えられています。br />IL-6は炎症性疾患や担がん環境下で産生される多機能性サイトカインの一つです。最近、私たちはマウスおよびヒト樹状細胞においてIL-6がMHCクラスIIの発現低下を引き起こし、T細胞への抗原提示能が減弱すること、マウス担がんモデルおよび大腸がん肝転移モデルにおいてIL-6欠損条件による抗腫瘍免疫応答の増強効果とともに著名な抗腫瘍効果を明らかにしました。
そこで、当分野では、がん治療モデルマウスやヒト末梢血由来の各種免疫担当細胞を使用し、慢性炎症性疾患や担がん生体におけるIL-6-STAT3シグナル伝達経路の活性化を介した抗腫瘍エフェクター細胞の機能不全メカニズムを詳細に解析し、がん・慢性炎症性疾患に対するより効果の高い治療法の開発に繋ぐ研究を展開しています。
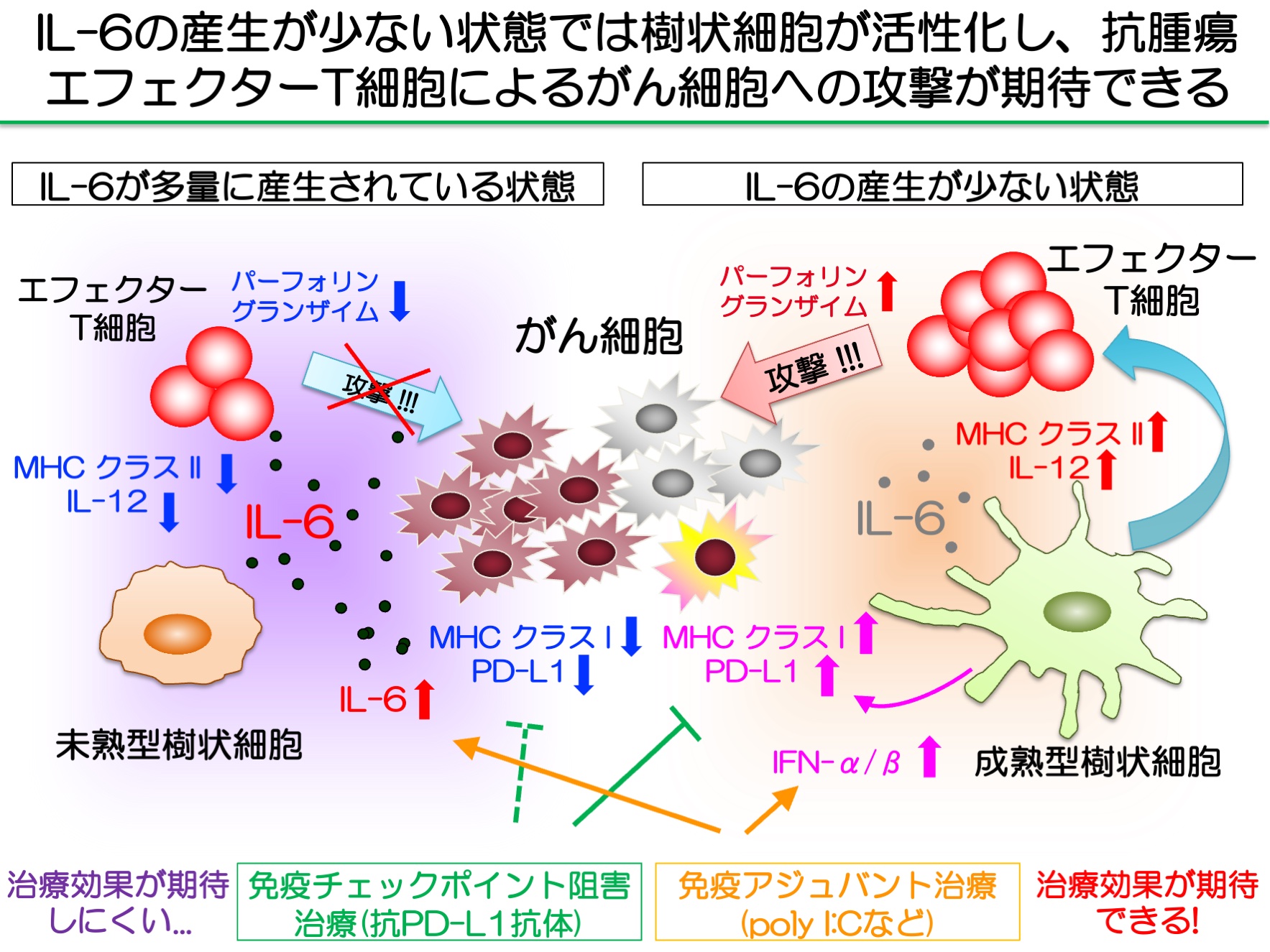
図3. 腫瘍微小環境において産生されるIL-6の抗腫瘍免疫に及ぼす効果
担がん生体内の腫瘍微小環境において産生されるIL-6は、樹状細胞に作用して抗原提示能が低下し、腫瘍環境下でエフェクターT細胞の誘導を抑制している。IL-6のシグナルの遮断により、樹状細胞や抗腫瘍エフェクターT細胞によるがん細胞への攻撃が期待できる。一方、免疫状態の賦活によりIFN-α/βなどI型インターフェロンの産生誘導により、がん細胞のPD-L1分子が発現増強するため、さらに免疫チェックポイント阻害による併用治療が有効であると考えられる。
