News
- 2024年 5月 7日 Ratih Kusumastutiさんが技術補助員として研究室に加わりました。ようこそ、Ratihさん。
- 2024年 3月20日 王雪冰くんの論文がJournal of Investigative Dermatologyにアクセプトされました。
- 2024年 2月15日 王雪冰くんの論文がJournal of Biochemistryに掲載されました。
- 2024年 1月10日 札幌北高等学校の5名の生徒さんが当研究室に職場訪問しました。「娘細胞はどうやって遺伝子を引き継ぐの?」というテーマで
教員からの説明を受けた後、顕微鏡観察などを行ってもらいました。 - 2023年 3月27日 医学部医学科1年生の布施俊一郎くんが遺制研ビジティングスチューデントとして研究室に加わりました。ようこそ、布施くん。
- 2022年11月28日 医学部医学科1年生の小泉悠さんが遺制研ビジティングスチューデントとして研究室に加わりました。ようこそ、小泉さん。
- 2022年 9月 1日 谷澤英樹 准教授、鍾奕洛 特任助教が着任して研究室に加わりました。
- 2022年 1月11日 医学部医学科2年生の峯﨑信究くんが遺制研ビジティングスチューデントとして研究室に加わりました。ようこそ、峯﨑くん。
- 2021年11月17日 医学院博士課程1年の王雪冰くんがラボメンバーとして研究室に加わりました。ようこそ、王くん。
- 2021年 8月18日 野間教授の研究課題が武田科学振興財団 生命科学研究助成に採択されました。
- 2021年 8月 1日 福内真貴子さんが技術補助員として研究室に加わりました。ようこそ、福内さん。
- 2021年 8月 1日 医学部医学科3年生の川越幹洋くんが遺制研ビジティングスチューデントとして研究室に加わりました。ようこそ、川越くん。
- 2021年 6月25日 野間教授の研究課題が三菱財団自然科学研究助成に採択されました。
- 2021年 4月 1日 上林倫子さんが分野秘書として研究室に加わりました。ようこそ、上林さん。
- 2021年 2月17日 野間教授の研究課題がノバルティス研究奨励金に採択されました。
- 2020年12月14日 野間教授の研究課題が上原生命科学財団研究助成金に採択されました。
- 2020年11月15日 野間教授の研究課題が住友財団研究助成金に採択されました。
- 2020年10月 1日 西川敦子さんが分野秘書・技術補助員として研究室に加わりました。ようこそ、西川さん。
- 2020年 4月 1日 野間教授が北海道大学の遺伝子病制御研究所に着任し、「ゲノム医生物学分野」を開設しました。
最近の研究成果
The Journal of Biochemistry. Online ahead of print (2024)
Therapeutic strategies targeting cellular senescence for cancer and other diseases.
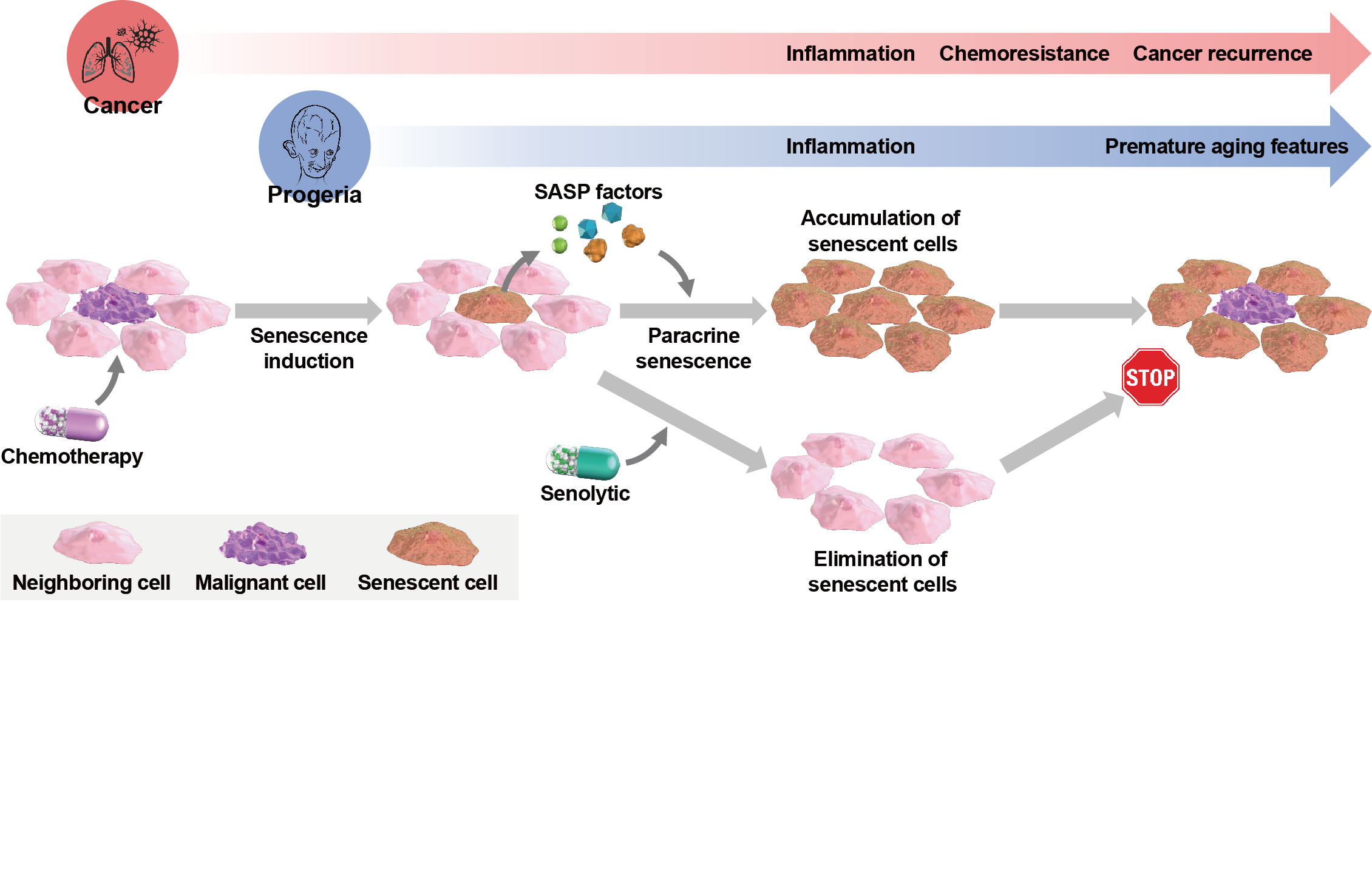
細胞老化は内因性および外因性ストレスによって誘導される。結果として生じる老化細胞は、細胞周期の安定した停止状態や細胞核の形態変化に加えて、炎症性因子の分泌に代表とされる細胞老化随伴分泌現象(senescence-associated secretory phenotype, SASP)といった特性を持つ。この老化細胞の増加とある種の癌や老化関連疾患の間に因果関係が確認されており、細胞老化が関与する疾患に対する新たな治療戦略として、老化細胞を選択的に取り除くセノリティック剤が注目を集めている。我々は、細胞老化と疾患の関係性とセノリティック剤を用いた治療法について、これまでの知見を総括した。
Nature communications 10, 5688 (2019).
Involvement of condensin in cellular senescence through gene regulation and compartmental reorganization.
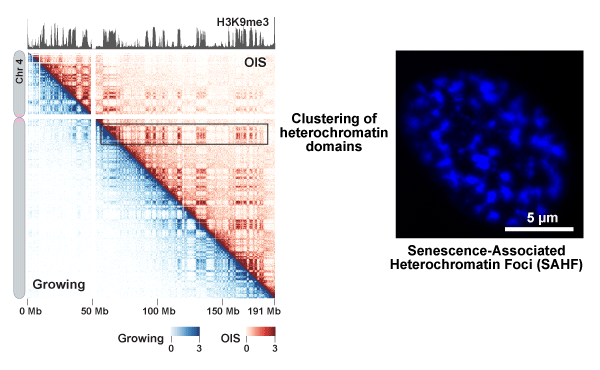
細胞老化によるゲノム構造の再編成
IMR90増殖細胞およびがん遺伝子誘発性老化(Oncogene-Induced Senescence; OIS)細胞を材料としてin situ Hi-C実験を行った。その結果として得られた全染色体構造データの内、ここでは4番染色体の結果を示す。OIS細胞由来のin situ Hi-Cデータ(右上)と増殖細胞由来のデータ(左下)を示す。へテロクロマチン領域に存在するヒストンH3 Lys9 tri-methylationの分布を一番上に示す。in situ Hi-C データにおいて、へテロクロマチンドメイン間の相互作用がOIS細胞で増殖細胞よりも強くなっていることが分かる。これは、DAPI染色によって可視化されたヘテロクロマチンの凝集(SAHF;右のパネル)が、ゲノミクス法でも検出できることを意味している。
Nature structural & molecular biology 24, 965–976 (2017).
Architectural alterations of the fission yeast genome during the cell cycle.
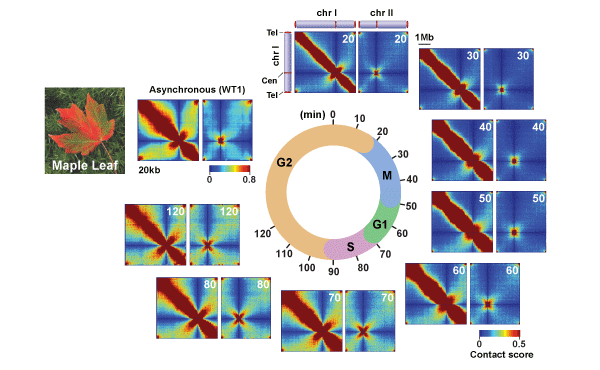
染色体内(chr1)および染色体間(chr1 と chr2)の相互作用マップ
cdc25-22 温度感受性変異株を用いて、細胞周期を同調させた後、再度細胞周期を進行させ、10分間隔で分裂酵母細胞を回収した。それら細胞周期の異なる細胞を用いてin situ Hi-C実験を行い、相互作用マップを作成した。因みに、in situ Hi-C法によって得られるゲノム全体の相互作用ネットワークが示すパターンは、大変美しいもので秋の楓の葉の紅葉を連想させる。
Annual Review of Genetics 51, 23-44 (2017)
The Yeast Genomes in Three Dimensions: Mechanisms and Functions
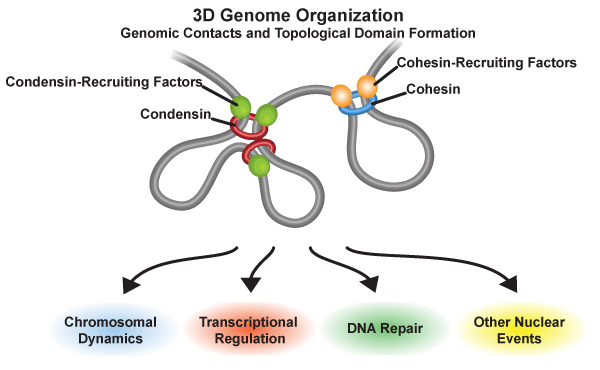
3D Genome Organization とその生物学的役割
コンデンシンとコヒーシンは、それぞれが結合するタンパク質を介してゲノム領域に導入される。 一旦コンデンシンとコヒーシンがゲノム上に導入されると、ゲノム領域間の相互作用を仲介すると同時に、トポロジカルドメインと呼ばれるドメイン構造を形成する。コンデンシンとコヒーシンがゲノム領域間の相互作用を仲介する分子プロセスの詳細は不明だが、結果として形成されるゲノム構造は、染色体動態、転写調節、DNA修復、及びその他の核内現象に関与する。
Nature Genetics 48, 1242–1252 (2016).
Transcription factors mediate condensin recruitment and global chromosomal organization in fission yeast.
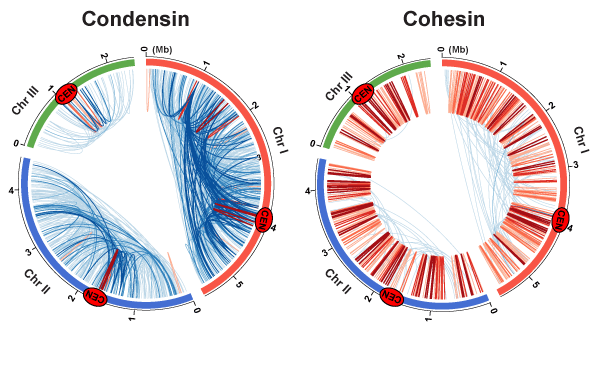
コンデンシンとコヒーシンによって形成されるゲノム領域間の相互作用マップ
ChIA-PET法を用いて、コンデンシン(左)とコヒーシン(右)が仲介するゲノム領域間の相互作用マップを作成した。 青線は100 kb以上、赤線は100 kb以内のゲノム領域間の相互作用を示す。Cenはセントロメアを表す。

