真核生物のゲノムは、規則性を持った構造体として核内に存在する。その構造は、転写、DNA 複製、DNA 修復等の様々な核内現象と密接に関わっており、その破綻は、ガンや発達障害に関わっていることが例証されている。これらの知見は、3D Genome Organization(ゲノム構造の 3 次元組織化)に関する研究が基礎生物学と医学の両分野に渡って重要であることを意味している。しかしながら現時点では、ゲノム構造を決定する分子メカニズムとその構造が核内現象に果たす役割に関して、十分な理解が得られていない。

3D Genome Organization とその生物学的役割
コンデンシンとコヒーシンは、それぞれが結合するタンパク質を介してゲノム領域に導入される。 一旦コンデンシンとコヒーシンがゲノム上に導入されると、ゲノム領域間の相互作用を仲介すると同時に、トポロジカルドメインと呼ばれるドメイン構造を形成する。コンデンシンとコヒーシンがゲノム領域間の相互作用を仲介する分子プロセスの詳細は不明だが、結果として形成されるゲノム構造は、染色体動態、転写調節、DNA修復、及びその他の核内現象に関与する。
Structural Maintenance of Chromosomes (SMC)タンパク質は、染色体の多くの動態において中心的な役割を果たす。これら SMC タンパク質を含む代表的な複合体がコンデンシンとコヒーシンであり、それぞれ分裂期の染色体凝縮と姉妹染色分体の接着に必須であることが示されている。以前から知られていたこれらの役割に加えて、最近では、コンデンシンとコヒーシンがゲノム領域間の相互作用や遺伝子の転写制御にも関与することが明らかとなってきた。つまり、これまでの研究成果は、コンデンシンとコヒーシンが 3D Genome Organization と核内現象の両方に関与することを示している。しかし、コンデンシンとコヒーシンがある決まったゲノム構造を形成する分子メカニズムと、結果として生じるゲノム構造が転写等の核内現象に果たす役割については未知な部分が多く残されている。そこで、当研究室では次世代シーケンサーを用いた最先端のゲノミクスはもとより、遺伝学、細胞生物学、生化学を絡めた様々な手法をヒトの培養細胞とモデル生物である分裂酵母に適用し、ゲノム構造を決定する分子メカニズムとゲノム構造が核内現象に果たす役割の解明を目的として研究を進めている。
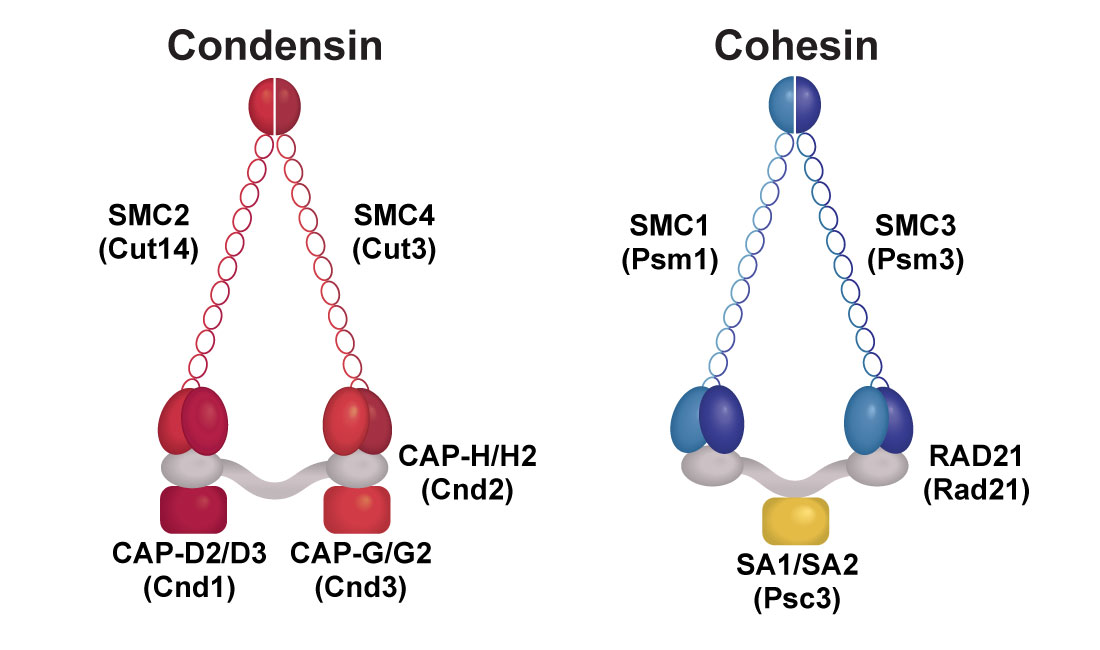
コンデンシンとコヒーシン複合体
ヒトのコンデンシンとコヒーシン複合体のサブユニット名を分裂酵母のサブユニット名の上に示す。ヒトにはコンデンシン I と II の 2 種類の複合体が存在する。コンデンシン I と II の共通のサブユニットである SMC2 と SMC4 に加えて、コンデンシン I は、CAP-D2、CAP-G、CAP-H を、コンデンシン II は、CAP-D3、CAP-G2、CAP-H2 を含む。
細胞老化とゲノム構造の 3 次元組織化
細胞老化は、ヒト線維芽細胞が無限に増殖せず、「Hayflick 限界」に到達し、それ以上細胞分裂を起こさない現象として Hayflick 博士によって定義された。さらに、現在では、細胞老化は、DNA 複製能力の枯渇、DNA 損傷、がん化学療法、がん遺伝子(発がん性 Ras)の過剰発現などの様々な細胞ストレスによって引き起こされる非常に安定した細胞周期停止状態として認識されている。我々の研究室では、がん遺伝子の過剰発現によって誘導されるがん遺伝子誘発性老化(Oncogene-Induced Senescence; OIS)と、DNA 複製由来のテロメア配列短縮によって誘発される複製老化(Replicative Senescence; RS)の 2 つのタイプの細胞老化に焦点を当てて研究を進めている。

老化細胞の SA-ß-gal および DAPI 染色パターン
IMR90 肺組織由来の線維芽細胞を細胞老化マーカーである SA-ß-gal で染色することにより、老化細胞を検出した(左)。加えて、 増殖している細胞と老化細胞(OIS と RS)を DAPI を用いて染色した(右)。
細胞老化は、がん遺伝子の活性化や DNA 損傷などのストレスを受けている細胞の増殖を停止させる働きを持つため、極めて重要ながん抑制メカニズムとして機能している。つまり p53 や Rb などの細胞老化において重要な役割を担う遺伝子の多くは、がん抑制遺伝子として認識されている。一旦、細胞老化が誘導されると、ゲノム上に分布する多くの遺伝子の発現が変化することが知られているが、その中でも特に老化関連分泌表現型(Senescence-Associated Secretory Phenotype; SASP)因子をコードする遺伝子群(SASP 遺伝子群)は、その転写が最も顕著に活性化される。インターロイキン、ケモカイン、成長因子、およびマトリックスメタロプロテイナーゼ等が SASP 因子に含まれ、加えてオートファジーやリソソーム機能に関連する遺伝子も老化細胞でその発現が活性化される。これら細胞老化プロセス中に活性化される遺伝子は、総称して老化遺伝子と呼ばれる。
また、老化細胞は、Senescence-Associated Heterochromatic Foci(SAHF)と呼ばれるゲノム上に分布するヘテロクマチン領域が凝集した構造体(下図を参照)やセントロメア周辺のサテライト DNA 領域の膨張など、老化細胞にしか見られない特殊なゲノム構造を形成することが知られている。つまり、細胞老化は、ゲノム構造の再編成を伴う核内現象ということになる。しかし、細胞老化プロセス中に形成されるゲノム構造と、そのゲノム構造が老化遺伝子の転写活性化に果たす役割に関しては、未だ不明な点が多く残されている。
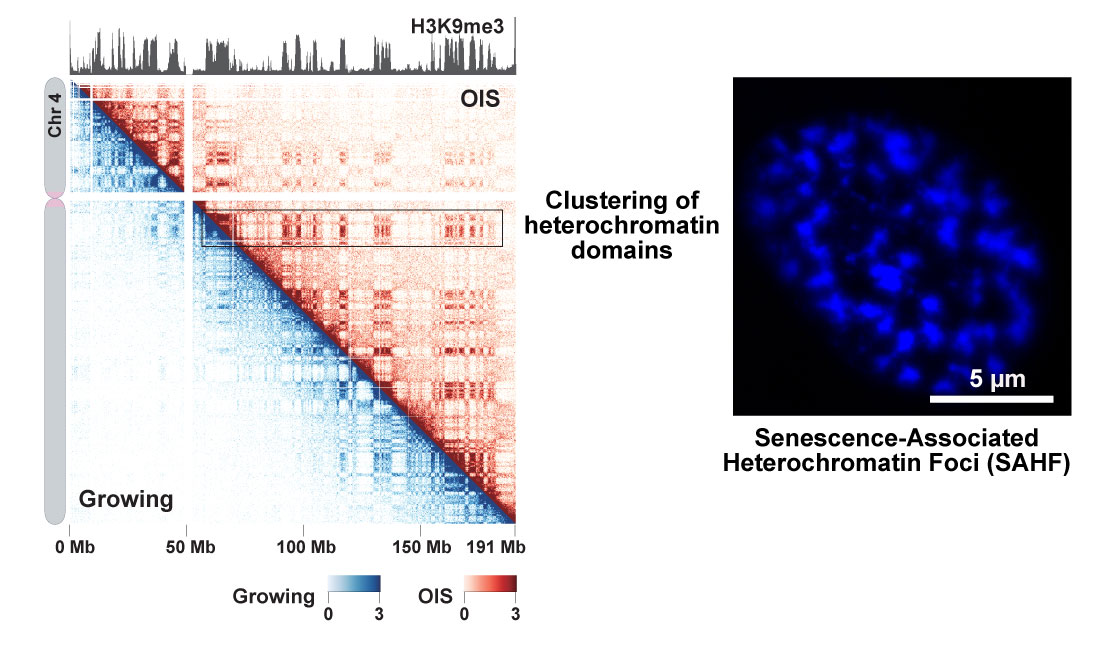
細胞老化によるゲノム構造の再編成
IMR90増殖細胞およびがん遺伝子誘発性老化(Oncogene-Induced Senescence; OIS)細胞を材料としてin situ Hi-C実験を行った。 その結果として得られた全染色体構造データの内、ここでは4番染色体の結果を示す。OIS細胞由来のin situ Hi-Cデータ(右上)と増殖細胞由来のデータ(左下)を示す。 へテロクロマチン領域に存在するヒストンH3 Lys9 tri-methylationの分布を一番上に示す。in situ Hi-C データにおいて、へテロクロマチンドメイン間の相互作用がOIS細胞で増殖細胞よりも強くなっていることが分かる。これは、DAPI染色によって可視化されたヘテロクロマチンの凝集(SAHF;右のパネル)が、ゲノミクス法でも検出できることを意味している。
私たちの研究室は、ゲノム構造を決定する主要なタンパク質複合体であるコンデンシンが細胞老化に関与することを明らかにした(Yokoyama et al. Cell Cycle 2015; Iwasaki et al. Nature Communications 2019)。コンデンシンは、OIS と RS 細胞に共通した老化細胞特異的ゲノム構造を形成すると同時に、p53 標的遺伝子および SASP 遺伝子を含む老化遺伝子の発現を最大限に活性化することに必要であるが分かってきた。以上の研究成果を踏まえ、当研究室では、コンデンシンが老化細胞において形成するゲノム構造に関して理解を深めると同時に、老化遺伝子の転写を活性化する分子メカニズムを解明することを目的として研究を行っている。さらにその先は、コンデンシンが形成するゲノム構造の破綻が老化遺伝子(がん抑制遺伝子)の転写異常を介し、発がんプロセスを誘導する分子機構の解明を見据えている。
細胞老化に関連した研究テーマ
- OIS 細胞に形成されるゲノム構造を包括的に理解し、コンデンシンによって形成されるゲノム構造を明らかにする。
- OIS 細胞を用いて、コンデンシンが p53 標的遺伝子と SASP 遺伝子の転写を活性化する分子機構を解明する。
- コンデンシンによって形成されるゲノム構造と老化遺伝子の活性化の相関を明らかにする。
- OIS と RS 細胞に共通したゲノム構造形成と転写制御機構におけるコンデンシンの役割を明らかにする。
分裂酵母を用いたゲノム構造の 3 次元組織化メカニズムの解明
コンデンシンとコヒーシンは、ゲノム構造の 3 次元組織化に重要な役割を担っている。当研究室では、ChIA-PET と呼ばれるゲノミクス法を用いて、コンデンシンとコヒーシンによって仲介されるゲノム領域間の相互作用を包括的にマッピングした。その結果、コンデンシンとコヒーシンは、高い頻度で同じゲノム領域に存在するが、それぞれが形成するゲノム領域間の相互作用は、その距離において全く異なっていることが明らかとなった。コンデンシンは、主に 100 kb 以上離れた遠距離の相互作用を、それに対してコヒーシンは、100 kb 以内の近距離の相互作用を仲介する。結果、それぞれ 100 kb 以上と 100 kb 以内の大小異なるサイズのドメイン構造が形成される(Kim et al. Nature Genet 2016)。
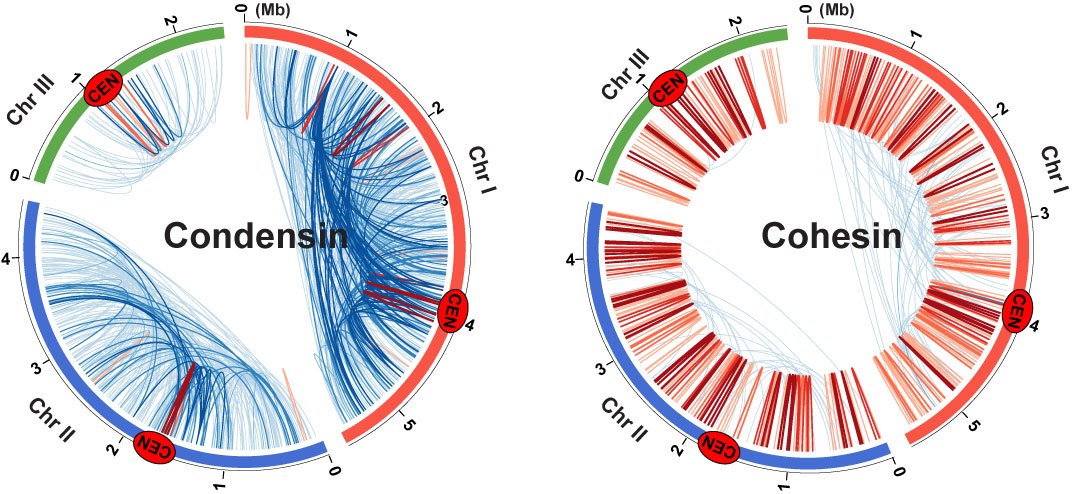
コンデンシンとコヒーシンによって形成されるゲノム領域間の相互作用マップ
ChIA-PET法を用いて、コンデンシン(左)とコヒーシン(右)が仲介するゲノム領域間の相互作用マップを作成した。 青線は100 kb以上、赤線は100 kb以内のゲノム領域間の相互作用を示す。Cenはセントロメアを表す。
さらに当研究室では、in situHi-C と呼ばれるもう 1 つのゲノミクス法を用いて、分裂酵母ゲノム構造の細胞周期を通した変化を解析した。その結果、コンデンシンが有糸分裂期に先述の ChIA-PET 法で検出されたものと同じ、大きいドメイン構造を形成し、その構造体が染色体凝縮のユニットとして機能することが明らかとなった(Tanizawa et al. Nature Structural&Molecular Biology 2017)。コンデンシンによるドメイン構造が細胞周期を通して変化するのに対し、コヒーシンによって形成される小さいドメイン構造は、細胞周期を通して安定に維持されている。現在研究中のコンデンシンおよびコヒーシンによるゲノム構造形成メカニズムに関しては、総説に我々の仮説を詳述している(Noma. Annual Review of Genetics 2017)。
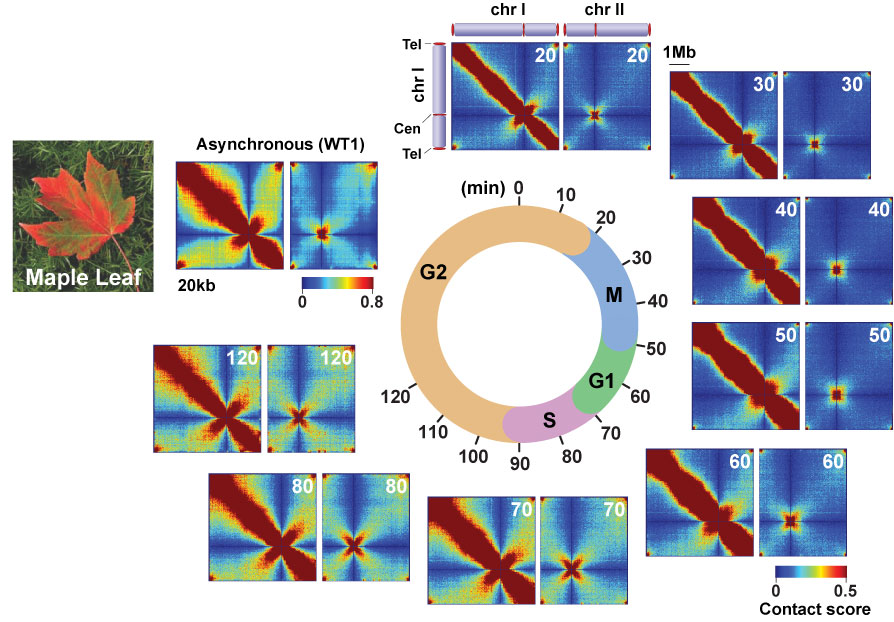
染色体内(chr1)および染色体間(chr1 と chr2)の相互作用マップ
cdc25-22温度感受性変異株を用いて、細胞周期を同調させた後、再度細胞周期を進行させ、10分間隔で分裂酵母細胞を回収した。それら細胞周期の異なる細胞を用いてin situ Hi-C実験を行い、相互作用マップを作成した。因みに、in situ Hi-C法によって得られるゲノム全体の相互作用ネットワークが示すパターンは、大変美しいもので秋の楓の葉の紅葉を連想させる。
コンデンシンが関与するゲノム構造形成メカニズムの一部を説明すると、これまでの私たちの研究結果は、コンデンシンが TATA ボックス結合タンパク質(TBP)や転写因子と直接的または間接的に結合することを示唆した(Iwasaki et al. Mol Cell 2015; Kim et al. Nature Genet 2016)。現時点での仮説として、コンデンシンは、TBP や転写因子により遺伝子領域に導入され、ゲノム領域間の相互作用を仲介すると考えている。TBP は基本転写因子であり、RNA ポリメラーゼ I、II、III による全ての転写型に必須なタンパク質である。つまり、ゲノム上のあらゆる転写活性とゲノム構造は、コンデンシンと TBP 間の結合により結び付けられていると推察される。加えて、コンデンシンと TBP 間の結合は、分裂酵母のみならず、ヒトでも保存されていた。これまでの研究成果を踏まえ、今後、コンデンシンが遺伝子の転写活性とゲノム構造を結びつけるメカニズムの解明に迫っていきたい。

コンデンシンによるゲノム領域間の相互作用とドメイン形成を説明するモデル
コンデンシン(赤いリング)は、TATAボックス結合タンパク質および転写因子によって遺伝子領域(緑)およびドメイン境界(青)に導入される(第1段階;上段のパネル)。導入されたコンデンシンは、ゲノム領域間の相互作用を仲介し(第2段階;中央のパネル)、最終的にドメインが形成される(第3段階;下段のパネル)。
ゲノム構造の組織化メカニズムに関連した研究テーマ
- コンデンシンが TBP および転写因子との結合を介してゲノム上に導入され、ゲノム構造を形成するメカニズムを解明する。
- コンデンシンによって形成されるゲノム構造と遺伝子の転写制御の関係を明らかにする。
- 分裂酵母のゲノム構造形成メカニズムがヒトでどのように機能しているのかを解明する。
