研究成果
投稿日:2025-09-17
試験管内でオートファジーの初期過程を再現することに成功 ~オートファジー促進剤の開発に期待~(生命分子機構分野)
生命分子機構分野の藤岡優子准教授及び野田展生教授、東京科学大学総合研究院細胞制御工学研究センターの中戸川仁教授らの研究グループは、オートファジーの中核であるオートファゴソーム*1新生の初期過程を試験管内で再構成することに成功し、液−液相分離によりオートファジーが始まるメカニズムの詳細を明らかにすることに成功しました。
オートファジーとは、有害凝集体や損傷ミトコンドリアなどの分解を行う現象であり、細胞の恒常性を維持する役割を持ちます。オートファジーは栄養飢餓などで活性化されますが(=オートファジー誘導)、この異常に伴って神経変性疾患やがんが引き起こされます。
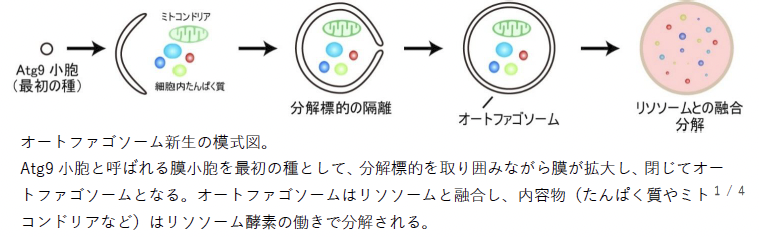
オートファジーが誘導されると、Atgたんぱく質*2が液−液相分離*3によりPAS*4という液滴*5を作ります。このPAS液滴が作られることで、オートファゴソームの新生が進むと考えられていますが、その機能は未解明でした。
本研究では主要Atgたんぱく質を高純度精製してPAS液滴を試験管で再構成し、各因子の液滴濃縮度を定量比較した結果、Atg8*6の脂質化を担うE3酵素であるAtg12–Atg5–Atg16複合体*7が最も濃縮されることが分かりました。そしてPAS液滴においてAtg8の脂質化が高効率で進行すること、それにともない膜小胞がPAS液滴内部へ取り込まれることが分かりました。
以上の結果から、PAS液滴がAtg8の脂質化を行う場所として働き、オートファゴソームの最初の膜の種であるAtg9小胞*8を集めることで、オートファゴソーム新生を開始するという一連のメカニズムが明らかになりました。本研究の成果は、オートファゴソーム新生の全過程のメカニズム解明と、高い特異性を持ったオートファジー促進剤・阻害剤創出の基盤になることが期待されます。
なお、本研究成果は、2025年9月16日(火)公開のNature Structural & Molecular Biology誌に掲載されました。
【論文名】
Phase separation promotes Atg8 lipidation and vesicle condensation for autophagy progression(相分離は、オートファジーの進行に向けてAtg8の脂質化と小胞の凝縮を促進する)
【著者名】
Yuko Fujioka1、Takuma Tsuji1、Tetsuya Kotani2、Hiroyuki Kumeta3、Chika Kakuta2、Junko Shimasaki2、Toyoshi Fujimoto4、Hitoshi Nakatogawa2、Nobuo N. Noda1,5(1北海道大学遺伝子病制御研究所、2東京科学大学総合研究院、3北海道大学大学院先端生命科学研究院、4順天堂大学大学院医学研究科、5公益財団法人微生物化学研究会微生物化学研究所)
【雑誌名】
Nature Structural & Molecular Biology(構造生物学、分子生物学の専門誌)
【DOI】
10.1038/s41594-025-01678-3
【公表日】
2025年9月16日(火)(オンライン公開)
【用語解説】
*1 オートファゴソーム … オートファジーが誘導されると、細胞質に新たに作り出される二重膜のオルガネラのことであり、オートファジーにおける最も特徴的かつ基本的な構造体である。オートファゴソームで囲まれたものはリソソームへと運ばれて分解される。
*2 Atgたんぱく質 … 酵母で同定されたオートファジーに関与するたんぱく質群の名称で、これまでに40種類以上報告されている。
*3 液−液相分離 … 均一な溶液が複数の液相に分離する現象であり、日常生活でも水と油の分離としてよく観察される。細胞内ではたんぱく質や核酸が液−液相分離することが知られている。
*4 PAS … プレオートファゴソーム構造体の略。酵母において、栄養飢餓になると液胞近傍の1ヵ所にAtgたんぱく質が集まるが、この集まった構造を指す。
*5 液滴 … たんぱく質や核酸が液−液相分離することで形成した液体状の会合体。液滴は膜のないオルガネラとも呼ばれ、細胞内で様々な機能を担っている。
*6 Atg8 … ユビキチンと類似したたんぱく質で、E1、E2、E3酵素の働きで脂質修飾されることでオートファジーに働く。
*7 Atg12-Atg5-Atg16複合体 … Atg8の脂質修飾を担うE3酵素のこと。この複合体自体がE1、E2酵素の働きでAtg12とAtg5が共有結合することで形成される。
*8 Atg9小胞 … ゴルジ体で形成される、膜たんぱく質Atg9を含んだ膜小胞のこと。オートファゴ ソーム新生の最初の膜の種として働くと考えられている。
投稿日:2025-08-29
ストレスが抗ウイルス応答を選択的に調整する仕組みを発見 ~ウイルス感染症に対する新たな治療展開に期待~(分子細胞生物研究室)
北海道大学遺伝子病制御研究所の岡崎朋彦准教授らの研究グループは、東京大学と徳島大学との共同研究により、抗ウイルス応答において中心的な役割を担うタンパク質MAVS(ミトコンドリア抗ウイルスシグナル伝達タンパク質)が、細胞ストレスに起因するシグナル経路によってリン酸化修飾を受けることで、インターフェロン(IFN)産生が促進されることを明らかにしました。
私たちの体を構成する細胞は、酸化ストレスや小胞体ストレスなど様々なストレスにさらされており、それに対抗する「細胞ストレス応答」という仕組みを備えています。近年、この仕組みは細胞を守るだけではなく、免疫応答の調節にも関わることが明らかになってきました。
ウイルスに感染した細胞は、抗ウイルス物質インターフェロン(IFN)を産生して周囲の細胞に警告を発するか、あるいは、感染細胞が自ら死を選ぶ(アポトーシス)など、異なる対応を取ります。この応答の中心にあるのが、MAVSです。岡崎准教授らの研究グループはこれまでに、ストレス応答にも関わる酵素群「ASKファミリー」が、MAVSを介した免疫応答を制御することを発見してきました。さらに、最近の知見により、ストレスが免疫応答の「強さ」だけではなく、「質」にも影響を与える可能性が示唆されています。
しかしながら、どのストレス経路が、どのような仕組みでMAVSの活性や免疫応答を制御しているのかは依然として不明でした。
本研究では、ストレス応答に関わるASKファミリーに着目し、ASK1がp38 MAPKを介して、MAVSのリン酸化を誘導することを発見しました。さらに、このリン酸化が、IFN応答を選択的に増強する一方で、感染細胞のアポトーシスには影響を与えないことを明らかにしました。つまり、細胞ストレスはMAVSのリン酸化を介して、免疫応答の方向性を制御していることが示されました。
本研究で明らかになった分子機構は、ウイルス感染症に対する新たな治療戦略の糸口となると期待されます。
なお、本研究成果は、2025年8月13日(水)公開のiScience誌にオンライン掲載されました。

投稿日:2025-07-04
GGCX膜トポロジー反転による細胞質タンパク質カルボキシル修飾の発見 ~ビタミンKが抗ウイルス防御に働く新たな仕組みを同定~(分子細胞生物研究室)
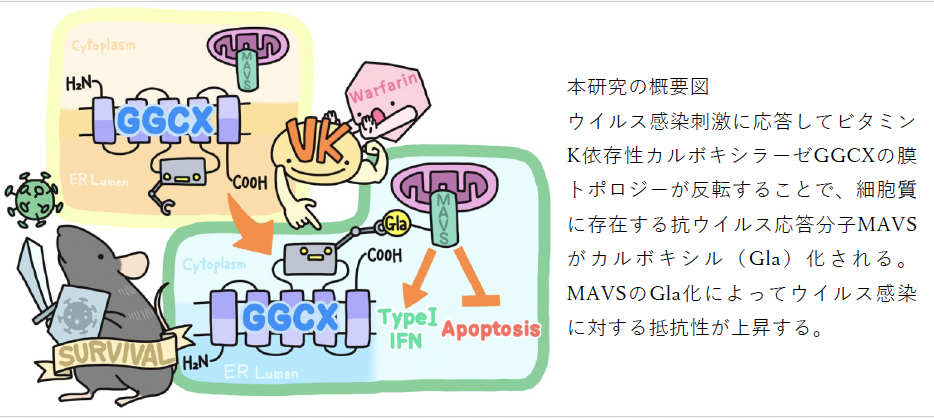
北海道大学遺伝子病制御研究所の岡崎朋彦准教授、東京大学大学院薬学系研究科の野崎啓史大学院生(研究当時)及び後藤由季子教授らの研究グループは、理化学研究所統合生命医科学研究センターとの共同研究により、抗ウイルス応答の鍵となるタンパク質MAVS(ミトコンドリア抗ウイルスシグナル伝達タンパク質)が、細胞質においてビタミンK依存性のカルボキシル化(特定のアミノ酸にカルボキシル基[–COOH]が付加される修飾)を受けることを明らかにしました。
従来、カルボキシル化は小胞体内腔または細胞外のタンパク質に限定された修飾とされてきましたが、本研究では、小胞体膜貫通酵素GGCX(γ-グルタミルカルボキシラーゼ)が膜トポロジーを反転させることで、細胞質側でMAVSのカルボキシル化を可能にするという、新たな分子機構を発見しました。この修飾は、MAVSがインターフェロン応答を強化し、ウイルスごと自殺するアポトーシスを抑制する「スイッチ」として機能し、ウイルス感染に対する細胞の防御力を高めることが示されました。さらに、ビタミンKの欠乏や、GGCXを阻害する抗凝固薬ワルファリンの投与によって、マウスのウイルス感受性が上昇することが確認され、ビタミンKの栄養状態と抗ウイルス免疫の関連性が新たに明らかになりました(P1図)。
なお、本研究成果は、日本時間2025年7月4日(金)公開のScience誌に掲載されました。
投稿日:2025-06-30
すい管腺がん細胞の細胞死を誘導する新たな手法を発見 〜難治性がんに対する新たな治療法開発の加速に期待〜(がん制御学分野)
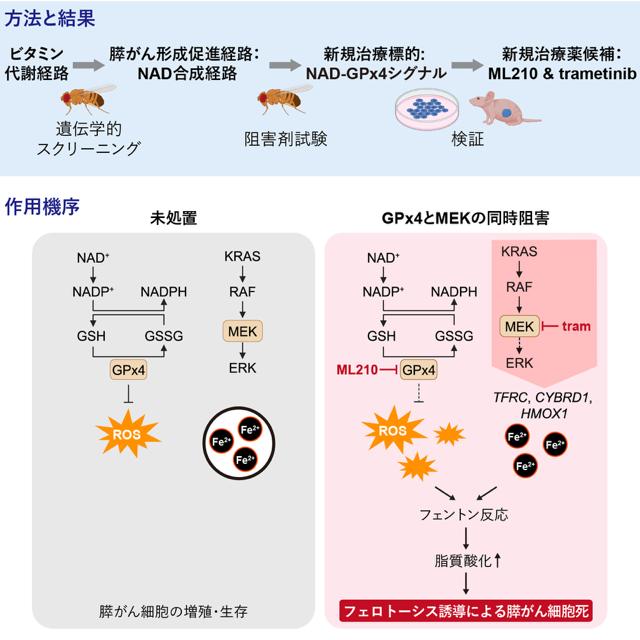
がん制御学分野の園下将大教授、株式会社フライワークスらの研究グループは、すい臓に発生するがんの大部分を占めるすい管腺がん(PDAC)の新たな代謝的脆弱性としてニコチンアミドアデニンジヌクレオチド(NAD)合成経路を同定しました。
さらに、NAD合成経路の下流で機能するGPx4が、PDACの治療標的であることを見出しました。特に、GPx4阻害剤ML210とMEK阻害剤trametinibを併用することで、ヒトPDAC細胞の細胞死(フェロトーシス)を誘導してPDAC形成を抑制できることを発見し、この組み合わせ療法がPDACに対する有望な治療戦略となる可能性を示しました。
PDACは、すい臓がんの一種で、5年生存率がわずか10%という極めて予後不良ながんとして知られています。また、治療法の選択肢が極めて限られている代表的な難治がんの一つであり、高齢化の進行や生活習慣の変化などにより罹患者数の増加が予想されています。そのため、新たな治療標的の同定や治療薬の開発は、喫緊の福祉課題とされています。
研究グループはこれまでの研究成果から、治療の鍵は、体内の代謝やエネルギー産生などに必要不可欠なビタミンB群にあると考えました。ビタミンB群は食物に含まれる身近な栄養素ですが、これらがPDACの発生や進展において果たす役割は十分に解明されていません。
そこで研究グループは、ヒトPDACの遺伝子変異パターンを模倣したモデルショウジョウバエを用いて、それらの代謝を抑制した際の影響を解析しました。その結果、特にビタミンB3の代謝経路が駆動するNAD合成経路を阻害することで、このモデルハエの生存性が上昇すること、そして活性酸素種(ROS)を除去する活性を有するGPx4がこの経路における重要なエフェクターであることが分かりました。
さらに、GPx4及びMEKの同時阻害は、ヒトPDAC細胞を移植したモデルマウスにおいて、ROS蓄積を介したフェロトーシスを誘導し、腫瘍の成長を抑制しました。本研究成果は、フェロトーシス誘導を介したPDACの新規治療法の開発に貢献すると期待されます。
なお、本研究成果は、2025年5月30日(金)公開のMolecular Therapy誌にオンライン掲載されました。
【論文名】
Inhibition of NAD-GPx4 axis and MEK triggers ferroptosis to suppress pancreatic ductal adenocarcinoma (NAD–GPx4 シグナルとMEK の同時阻害は、フェロトーシスを誘導してすい管腺がんの形成を抑制する)
【雑誌名】
Molecular Therapy(分子標的療法の専門誌)
DOI: 10.1016/j.ymthe.2025.05.037
投稿日:2025-03-11
多能性幹細胞移植による移植免疫寛容誘導現象を発見 〜他家iPS細胞由来組織移植における拒絶反応制御法確立への発展に期待〜(免疫生物分野)
免疫生物分野の鎌谷智紀氏、清野研一郎教授は、住友ファーマ株式会社との共同研究により、多能性幹細胞(iPS細胞またはES細胞)が移植免疫寛容*1を誘導することを発見し、そのメカニズムを解明しました。
他家移植(他者の臓器や細胞を移植すること)では、細胞の遺伝子型が一致せず、免疫拒絶反応が生じます。そのため、通常は免疫抑制剤を投与することが必要です。このことは、他家iPS細胞やES細胞を用いた再生医療においても同様です。研究グループは、以前より免疫抑制剤を必要としない他家移植方法の研究を続け、その中で、あるマウスの組み合わせでは多能性幹細胞を他者に接種(注射)しても拒絶されないことをまず発見しました。さらに、一旦多能性幹細胞が生着したマウスに別の移植片(本研究では皮膚)を移植すると、驚くべきことにこの皮膚移植片を拒絶せず、免疫寛容という状態が誘導されることを発見しました。
本現象を詳しく調べてみると、拒絶されない組み合わせはMHC*2型一致・マイナー抗原*3不一致の同種異系の場合であることが分かりました。また、2番目に移植した皮膚移植片が生着するのは皮膚が多能性幹細胞と同系の場合のみであること(抗原特異性があること)が明らかになりました。そして、この免疫寛容の誘導効率は、時間の経過と共に高くなることも明らかになりました。そのメカニズムを解析した結果、多能性幹細胞の生着後、免疫制御性細胞の一つであるTreg*4が増加していること、Tregを除去すると移植免疫寛容が誘導されなくなることが明らかになり、本現象におけるTregの重要性が示されました。
今回の研究成果は、これまでに知られていない多能性幹細胞の免疫寛容に関する新しい性質が明らかにされ、基礎生物学的な理解が深まるという意味があります。今後、詳細なメカニズムをさらに明らかにすることで、iPS細胞やES細胞を用いた移植医療(再生医療)における新規拒絶反応抑制法や、免疫抑制剤を必要としない免疫寛容誘導法の確立に発展する可能性があります。
なお、本研究成果は、日本時間2025年3月11日(火)午前5時公開のProceedings of the National Academy of Sciences of the United States of America(PNAS)誌にオンライン掲載されました。
【論文名】
iPSCs engrafted in allogeneic hosts without immunosuppression induce donor-specific tolerance to secondary allografts(非免疫抑制下で同種異系マウスに生着したiPS細胞はドナー抗原特異的な免疫寛容を誘導する)
【著者名】
鎌谷智紀1、木村礼子1、池田聡2、井上誠2、清野研一郎1(1北海道大学遺伝子病制御研究所免疫生物分野、2住友ファーマ株式会社)
【雑誌名】
Proceedings of the National Academy of Sciences(PNAS、米国科学アカデミー紀要)
DOI: https://doi.org/10.1073/pnas.2413398122
【用語解説】
*1 免疫寛容 … ドナーに対して免疫的に不応答であり拒絶のリスクがない状態。
*2 MHC …主要組織適合抗原複合体。一般的に白血球の型と呼ばれる分子のこと。一致していないと免
疫応答が生じ、拒絶が起こりやすい。ヒトの場合はHLA(ヒト白血球抗原)と言う。
*3 マイナー抗原 … HLA(MHC)以外で拒絶反応に関与するタンパク質のこと。
*4 Treg … 制御性T細胞。抗原特異的な免疫抑制能を持つことが知られている。
投稿日:2025-01-30
免疫抑制性の新規自己マクロファージ細胞療法を開発 〜肝硬変に対する新たな治療方法の提案が期待〜(免疫生物分野)
免疫生物分野の五十嵐佑一学術研究員、清野研一郎教授らは、株式会社メディネット、かずさDNA研究所との共同研究により、新しい方法で誘導した自己マクロファージが肝線維化の抑制、改善効果を示すことを明らかにし、そのメカニズムの一端を解明しました。
重度の肝硬変は肝移植による治療が一般的ですが、臓器移植ドナーが不足しており、移植できたとしても生涯にわたる免疫抑制剤の服用が必要になるなど、種々の問題点が残っています。これまでの研究により、患者本人の免疫細胞の一つであるマクロファージを活用することで、肝硬変を抑制・改善できることが分かってきました。
本研究では、比較的新しいサイトカインであるIL-34とIL-4を組み合わせて誘導したマクロファージが、肝硬変の病態の本体である肝線維化を効果的に抑制することを発見しました。

IL-34+IL-4誘導マクロファージは、急性、慢性いずれのマウス肝炎モデルにおいても肝線維化を抑制し、原因タンパク質であるコラーゲンの沈着を抑えるほか、肝実質の中で死んでいく細胞を減少させることが分かりました。さらに、肝臓組織中の細胞傷害性T細胞の数を減少させる免疫抑制的な効果を有することも明らかとなり、その機序としてPD-1シグナルを介してT細胞の増殖を抑えることを突き止めました。これらIL-34+IL-4誘導マクロファージの性質は、ヒト細胞においても示されることを証明し、本研究成果が今後ヒト肝硬変患者さんへ臨床応用される可能性を示しました。
これらの研究成果は、今後の科学研究における自己細胞療法の開発にとって有益な情報を提供するとともに、さらなる作用機序の解明が肝硬変治療をより発展させる展望を提示します。
なお、本研究成果は、日本時間2025年1月24日(金)公開のInflammation and Regeneration誌に掲載されました。
【論文名】
Amelioration of liver fibrosis with autologous macrophages induced by IL-34-based condition(IL-34に基づく条件下で誘導された自己マクロファージによる肝線維化の改善)
【著者名】
五十嵐佑一1、和田はるか1、武藤真人2、曽根涼平2、長谷川 嘉則3、清野研一郎1(1北海道大学遺伝子病制御研究所免疫生物分野、2株式会社メディネット、3かずさDNA研究所ゲノム事業推進部)
【雑誌名】
Inflammation and Regeneration(日本炎症・再生医学会学誌)
DOI: 10.1186/s41232-025-00364-7
投稿日:2024-02-09
膵がんの新しい治療標的を発見 〜新規治療法の開発を加速〜(がん制御学分野)
遺伝子病制御研究所がん制御学分野の園下将大教授らの研究グループは、膵がんの新たな治療標的としてGSK3(Glycogen synthase kinase 3)を同定し、GSK3とMEK(Mitogen-activated protein kinase kinase)の同時阻害が膵がんの新規治療戦略の候補となることを見出しました。
膵がんは有効な治療法がほとんど存在しない代表的な難治がんの一つで、今後も罹患者数・死亡者数ともに増加し続けることが確実視されています。このため、新規治療標的の同定や治療薬開発が喫緊の福祉課題となっています。この課題を解決すべく研究グループでは最近、膵がん患者の中でも最も予後が悪い患者群で観察される四つの遺伝子変異(がん遺伝子KRASの活性化とがん抑制遺伝子群TP53・CDKN2A・SMAD4の不活性化)を再現した「4-hitハエ」を作出し、このハエが膵がんの新規治療標的や哺乳類モデルでも有効な治療薬シーズの同定に有用であることを見出していました。

本研究では、この4-hitハエを用いて全キナーゼを対象とする遺伝学的スクリーニングを実施し、GSK3の発現の阻害が腫瘍形質の減弱をもたらすことを見出しました。また、膵がん臨床検体における免疫組織化学的解析により、GSK3の高発現が膵がん患者の予後の悪化と有意に相関することが分かりました。研究グループはこれまでに、MEKが膵がん形成に重要な役割を果たすことを見出していましたが、本研究でGSK3阻害剤CHIR99021とMEK阻害薬trametinibの組み合わせが、マウスに移植した4-hit保有ヒト膵がん細胞の増殖を有意に抑制することも発見しました。加えて研究グループは、この組み合わせが細胞分裂制御因子として知られるPLK1(Polo-like kinase 1)の活性の低下を招来することも見出し、実際に4-hitハエでPLK1の発現を低減すると腫瘍形質が減弱することを確認しました。
これらの結果は、臨床検体・マウス・ショウジョウバエを相補的に活用した独自の異分野融合研究基盤を駆使することで、膵がんの発生機序解析や治療薬シーズ同定を個体レベルで効率的に実施できることを示しており、今後の治療薬開発への貢献が期待されます。
なお、本研究成果は、2024年2月6日(火)公開の日本癌学会の機関誌Cancer Science誌にオンライン掲載されました。
論文名:Concurrent targeting of GSK3 and MEK as a therapeutic strategy to treat pancreatic ductal carcinoma
(膵がんの新規治療戦略としてのGSK3・MEK同時阻害)
DOI: 10.1111/cas.16100
投稿日:2023-11-14
私たちには免疫系があるのになぜ「がん」が発生するのか?(免疫生物分野)
北海道大学遺伝子病制御研究所の和田はるか准教授及び清野研一郎教授らの研究グループは、同研究所の近藤亨教授との共同研究により、免疫がある状態での「がん」の開始にはがん幹細胞によるマクロファージ(Mφ)の老化がカギとなっていることを突き止めました。
免疫系をもつ動物に「がん」が発生するのはなぜでしょうか。近年、「がん」の発端となる細胞として「がん幹細胞」が提唱されました。がん幹細胞を標的とした治療を行えば、理論上はがんの根治につながる可能性があるため、「がん幹細胞」を決定することは重要な課題となりました。しかし、ヒトやマウスのように免疫のある状態でもがんをつくる「がん幹細胞」については依然としてよく分からないままでした。そこで研究グループは“免疫のある状態でもがんを開始する「真のがん幹細胞」”とはどのようながん細胞であるかを探究することとしました。
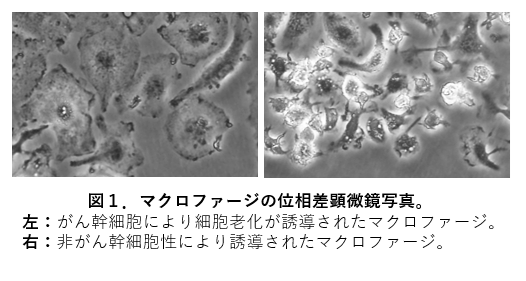
「がん幹細胞」と免疫のある状態ではがんをつくらない「非がん幹細胞」を比較解析したところ、がん幹細胞はIL-6を介してMφを細胞老化状態に誘導していることが明らかになりました(図1)。
細胞老化状態のMφは免疫抑制因子アルギナーゼ1を産生しており、腫瘍組織内のT細胞は活性化できない状態になっていました。このメカニズムにより、結果的にがん幹細胞は免疫のある状態においても免疫系からの監視を逃れ、がん組織の形成を可能にしていると考えられました(図2)。

更に研究グループは老化Mφが生命機能の維持に重要なNADを分解し減少させる老化関連分子CD38を高発現していることを発見しました。老化MφではNADの減少が予測されますが、代謝改善剤NMNの添加によりNAD量を回復することが可能です。そこでがん幹細胞を移植したマウスにNMNを投与したところ、がんの発生が減少することが分かりました。この結果から、がんの発生を阻止するためにNMNを用いる方法が有効である可能性が考えられました。
なお、本研究成果は、2023年11月14日(日本時間16時00分)公開のJournal for Immunotherapy of Cancer誌(DOI: 10.1136/jitc-2023-006677)に掲載される予定です。
本研究は、科学研究費補助金(26640066、16K18408)、AMED(日本医療研究開発機構)、加藤記念バイオサイエンス振興財団、寿原記念財団、秋山記念生命科学振興財団、日本白血病研究基金、三菱財団、遺伝子病制御研究所共同利用・共同研究拠点、新たな学際領域を生み出す異分野融合研究拠点をコアにした若手研究者育成拠点、フォトエキサイトニクス拠点等の支援のもと実施されました。
投稿日:2023-08-03
抗エストロゲン薬が免疫療法の効果を改善することを解明
~免疫チェックポイント阻害剤の治療効果向上を目的とした新たな治療戦略の確立に期待~(免疫生物分野)
遺伝子病制御研究所免疫生物分野の梶原ナビール氏(日本学術振興会特別研究員)、清野研一郎教授らの研究グループは、エストロゲン感受性を持たないとされる腫瘍においてもエストロゲンが腫瘍成長を促進しており、抗エストロゲン薬がその成長を抑制できること、さらには免疫療法(免疫チェックポイント阻害治療)の効果を改善できることを解明しました。
エストロゲンは、世間一般的に女性ホルモンと呼ばれており、女性の生殖器官や乳房をはじめとする性的発達に関与しています。がんの発生と進行においても、エストロゲンが重要な働きを担っており、実際エストロゲンへの曝露期間の長さが乳がんの発症に影響することも分かっています。しかし、がんに対するエストロゲンの影響は、エストロゲン感受性を持つ(エストロゲン受容体を発現している)腫瘍にのみ及ぶと考えられてきました。
本研究では、エストロゲン感受性を持たない(エストロゲン受容体を発現していない)腫瘍においても、エストロゲンが免疫系を抑制することで腫瘍の成長を促進していることを発見しました。また、抗エストロゲン薬の投与によりエストロゲンの働きを遮断すると、その免疫抑制が解除され、腫瘍の成長を遅延させることを明らかにしました。さらには、免疫チェックポイント阻害剤と併用することで劇的な抗腫瘍効果を得られることが判明しました。
今回得られた研究成果は、これまで一部の患者にしか使われてこなかった抗エストロゲン薬の適応拡大の可能性を示唆するものであり、抗エストロゲン薬を用いた全がん腫を対象としたドラッグリポジショニング戦略及び免疫チェックポイント阻害剤の治療効果向上を目的とした併用治療戦略の確立に繋がるものと期待されます。

なお、本研究成果は、2023年8月3日(木)公開のBritish Journal of Cancer誌にオンライン掲載されました。
論文名:Blocking of oestrogen signals improves anti-tumor effect regardless of oestrogen receptor alpha expression in cancer cells(エストロゲンシグナルの遮断はがん細胞におけるエストロゲン受容体アルファの発現にかかわらず抗腫瘍効果を向上させる)
著者名:梶原ナビール、戈 雲琪、清野研一郎(北海道大学遺伝子病制御研究所免疫生物分野)
雑誌名:British Journal of Cancer(腫瘍学の専門誌)
DOI:https://www.nature.com/articles/s41416-023-02381-0
投稿日:2023-07-24
抗がん剤や放射線治療の効果を左右する腫瘍内の免疫抑制機構を解明
~免疫抑制解除による新たながん免疫治療コンセプトの確立に期待~(免疫生物分野)
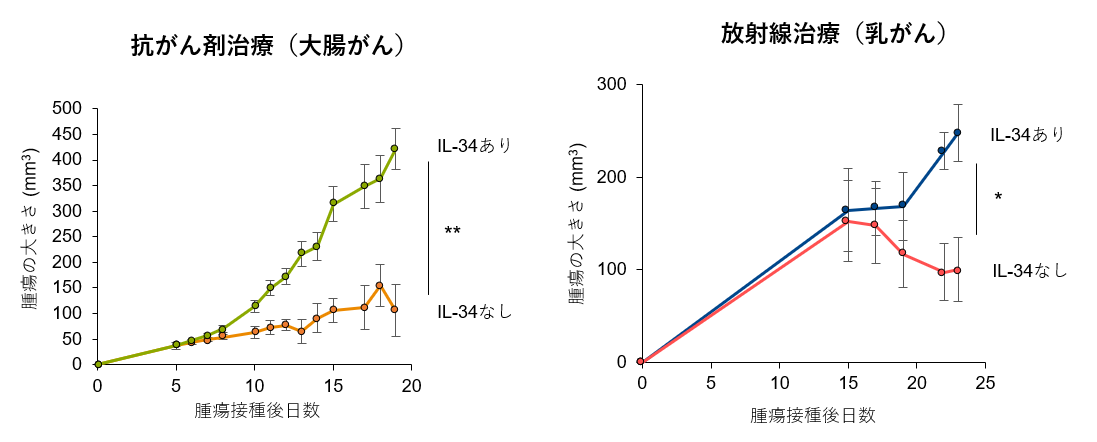
遺伝子病制御研究所免疫生物分野の韓ナヌミ助教(研究当時)、清野研一郎教授らの研究グループは、がん細胞が分泌するインターロイキン-34(IL-34)が、腫瘍内の免疫環境を変えることで、がん細胞に直接作用する治療法の効果を大きく左右することを解明しました。
抗がん剤や放射線治療といった古典的ながんの治療法は、がん細胞そのものに作用し、がん細胞を殺すことで抗腫瘍効果を発揮すると考えられてきました。しかし、これらの治療の効果には個人差があり、また同じ治療を続けるとだんだん効かなくなってくる、抵抗性の問題があります。そして、そのメカニズムは未だ完全に明らかにされたとは言えません。
本研究では、マウス大腸がん並びに乳がんモデルを用い、まず抗がん剤及び放射線治療の効果が発揮されるためにはT細胞の働きが重要であることを示しました。次に、IL-34が産生される腫瘍の中では、免疫抑制性マクロファージの数が増えている一方、T細胞の数並びに機能を発揮するための分子の発現が減少していることを見出しました。腫瘍細胞からIL-34が産生されない工夫をすると、抗がん剤並びに放射線治療の効果が著明に改善することを明らかにしました(図)。
本結果は、抗がん剤並びに放射線治療に対する治療抵抗性とIL-34の関係を示すものであり、IL-34を標的とした新規免疫治療コンセプトの確立に繋がるものと期待されます。
なお本研究成果は、2023年7月24日(月)公開のOncoimmunology誌にオンライン掲載されました。
論文名:A mechanism of IL-34-induced resistance against cytotoxic anti-cancer therapies such as radiation by X-ray and chemotherapy by Oxaliplatin(がんに対する殺細胞性治療(放射線治療及び抗がん剤)におけるIL-34が誘導する治療抵抗性のメカニズム)
著者名:韓ナヌミ、和田はるか、小林拓斗、大塚 亮、清野研一郎(北海道大学遺伝子病制御研究所免疫生物分野)
雑誌名:Oncoimmunology(癌免疫の専門誌)
DOI:10.1080/2162402X.2023.2238499
投稿日:2023-07-18
ピロリ菌が胃がん発症を促進する新たな仕組みを解明
~カエル胚の発生異常を手がかりにピロリ菌のがんタンパク質の新たな細胞内標的分子を発見~(感染がん研究センター)
遺伝子病制御研究所感染がん研究センター畠山昌則特任教授(公益財団法人微生物化学研究会・微生物化学研究所 部長兼任)らの研究グループが順天堂大学医学系研究科・生化学生体システム医科学 金光昌史助教らとともに行なった研究成果が米科学誌Scienceの姉妹誌である「Science Signaling」のオンライン版に掲載されました。
本研究はアフリカツメガエルの初期胚形成モデルならびにトランスジェニックマウス技術を駆使し、胃がん発症の鍵を握るピロリ菌の新規宿主標的として平面内細胞極性 (Wnt/PCP)と呼ばれる細胞の協調した集団移動を制御するシグナルを同定したもので、本シグナルが胃がんの発症母地となる胃上皮幹細胞制御の微小環境(ニッチ)形成に重要な働きを担うことを示すとともに、ピロリ菌がこのシグナルを撹乱することで胃上皮幹細胞回転の脱制御を引き起こし胃がん発症を促すことを明らかにしました。この成果は、がん治療の新たな分子標的としてのWnt/PCPシグナルの重要性を示すものです。
なお本研究は、日本学術振興会(JSPS)、日本医療研究開発機構(AMED)などの支援を受け、微化研/北大遺制研、順天堂大学に加え、東京大学、中央大学、基礎生物医学研究所、大阪大学、シンガポール国立大学/A-STAR、金沢大学からなる多施設国際共同研究として実施されました。
本研究成果は「Science Signaling」誌・7月18日号の表紙に採用されています。
The H. pylori oncoprotein induces stomach epithelial hyperplasia by impairing planar cell polarity signaling.
The strongest risk factor for gastric cancer is infection with Helicobacter pylori strains that inject the oncoprotein CagA into gastric epithelial cells. Now, an international research group led by Dr. Masanori Hatakeyama (Head, Laboratory of Microbial Carcinogenesis, Institute of Microbial Chemistry; Project Professor, Institute for Genetic Medicine, Hokkaido University) and Dr. Atsushi Takahashi-Kanemitsu (Assistant Professor, Juntendo University Graduate School of Medicine) found that CagA promotes gastric carcinogenesis by interfering with Wnt-mediated planar cell polarity (Wnt/PCP) signaling. They first demonstrated that ectopic expression of CagA disrupted Wnt/PCP–dependent morphogenetic processes in Xenopus embryogenesis. Based on this finding, they next generated transgenic mic that specifically express H. pylori CagA in the stomach epithelial cells and found hyperproliferation of pyloric gland base cells, which contain pyloric stem cells and the progenitor cells in the mouse stomach. CagA interfered with the signaling pathway by causing the mislocalization of Van Gogh-like (VANGL), a core component of the Wnt/PCP signaling complex. These findings suggest that Wnt/PCP signaling plays an in important role in regulating the stem cell niche in pyloric glands.
A research article describing this work was published online in Science Signaling on July 19, 2023 (JST).
投稿日:2023-06-29
世界初!ショウジョウバエを用いて膵がん治療標的を発見
~膵がんの新規治療薬開発への貢献に期待~(がん制御学分野)
遺伝子病制御研究所感染がん研究センター畠山昌則特任教授(公益財団法人微生物化学研究会・微生物化学研究所 部長兼任)らの研究グループが順天堂大学医学系研究科・生化学生体システム医科学 金光昌史助教らとともに行なった研究成果が米科学誌Scienceの姉妹誌である「Science Signaling」のオンライン版に掲載されました。
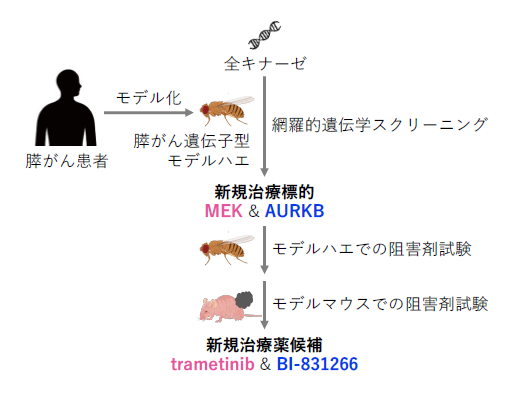
膵がんは治療法の選択肢が極めて限られている代表的な難治がんの一つであり、新規治療標的の同定や治療薬開発が喫緊の福祉課題となっています。研究グループでは以前から治療薬開発を効率化するためにハエを哺乳類と相補的に活用し、甲状腺髄様がんに対する治療薬候補を開発してきました。本研究では膵がん患者で観察される4遺伝子の変異(がん遺伝子KRASの活性化とがん抑制遺伝子群TP53・CDKN2A・SMAD4の不活性化)を再現した4-hitハエを世界で初めて作出し、このハエが過剰な細胞増殖や個体致死等の表現型を呈することを見出しました。
研究グループはこの4-hitハエを用いて全キナーゼの網羅的な遺伝学的スクリーニングを実施して、膵がんの新規治療標的としてMEKとAURKBを同定し、MEK阻害薬trametinibとAURKB阻害剤BI-831266の組み合わせが4-hitハエの生存率を改善することを発見しました。この組み合わせ療法はヒト膵がん細胞の皮下移植モデルマウスにおいても、単剤投与と比較して腫瘍の成長を有意に抑制しました。これらの結果は、4-hitハエを用いた遺伝学的スクリーニングが膵がん新規治療標的の同定に有用であることを示しており、今後ハエを用いたこの新規研究手法の活用により膵がんの発生素過程研究及び治療薬開発が一層進展することが期待されます。
なお、本研究成果は、2023年6月28日(水)公開の米国癌学会の機関誌Cancer Research誌にオンライン掲載されました。
論文名:Drosophila screening identifies dual inhibition of MEK and AURKB as an effective therapy for pancreatic ductal adenocarcinoma(膵がん遺伝子型モデルハエを用いたスクリーニングによる、MEKとAURKBを標的とする膵がんの新規組み合わせ療法の同定)
DOI:https://doi.org/10.1158/0008-5472.CAN-22-3762
投稿日:2023-06-15
iPS細胞から免疫寛容を誘導する細胞を作製(免疫生物分野)
清野研一郎教授(免疫生物分野)、村田智己氏(大学院医学院博士課程(当時))らの研究グループは、iPS細胞から造血幹・前駆細胞(iPSC-induced Hematopoietic Stem/Progenitor Cell: iHSPC)を分化誘導し、同細胞を用いて移植に伴う拒絶反応を制御することに成功しました。
現在行われている臓器移植では、ほとんどのケースでドナー(提供者)とレシピエント(受給者、移植患者)の間で免疫に関する遺伝子型が異なるため、拒絶反応が起きてしまいます。そのため、レシピエントは免疫抑制剤を生涯に渡って服用する必要があります。iPS細胞を用いた移植でも、ドナーとレシピエントが異なる場合(他家移植)、同様に拒絶反応が起きることが問題とされていました。
研究グループは、マウスを用いた実験で、ドナーとなるiPS細胞に造血に関わる因子(転写因子)を幾つか導入し、iHSPCを分化誘導することに成功しました。幾つかの前処置の後、他家のレシピエントマウスにこのiHSPCを注射したところ、20週間以上にわたってiHSPC由来の細胞が体内で生存していることが判明しました。このiHSPCを注射されたマウスにドナーiPS細胞と同じ遺伝子型の皮膚、またiPS細胞そのものを移植した場合、免疫抑制剤の投与なしに生着しました。
移植医療において拒絶反応の制御は最大の課題の一つです。今回iPS細胞から免疫寛容を誘導できる細胞が作製されたことで、今後の移植医療、特にiPS細胞を用いた移植医療への応用が期待されます。
なお、本研究成果は、2023年5月25日(木)公開のAmerican Journal of Transplantation誌に掲載されました。
【論文名】
Induced pluripotent stem cell–derived hematopoietic stem and progenitor cells induce mixed chimerism and donor-specific allograft tolerance(iPS細胞由来造血幹・前駆細胞は混合キメラ状態並びにドナー特異的移植免疫寛容を誘導する)
【著者名】
村田智己1, 2、羽馬直希1, 2、鎌谷智紀1, 2、森 淳祐1、大塚 亮1、和田はるか1、清野研一郎1(1北海道大学遺伝子病制御研究所免疫生物分野、2北海道大学大学院医学院)
【雑誌名】
American Journal of Transplantation(移植学の専門誌)
DOI:10.1016/j.ajt.2023.05.020
投稿日:2023-05-22
"効く" がん細胞ワクチンのメカニズムを解明
~ほぼ全ての患者さんに適用可能ながん細胞ワクチン開発に貢献する可能性~(免疫生物分野)
北海道大学遺伝子病制御研究所の和田はるか准教授、清野研一郎教授、同大学大学院医学院博士課程の梶原ナビール氏らの研究グループは、がん細胞ワクチンはほとんど効かないとされる中、“効く”がん細胞ワクチンの、効果を示すメカニズムを明らかにすることに成功しました。
がん細胞そのものを用いるがん細胞ワクチン療法は、がん細胞を得ることができれば、理論上ほぼ全ての患者さんに適用できる治療法となりうることから、大変期待されていました。しかし残念ながら、ごく一部を除きほとんどの例で有効性が見られませんでした。またごく一部の効く場合でも、なぜ効くのかが不明なままであり、近年ではほとんど顧みられなくなっていました。
研究グループは、マウスのがん細胞株では非常に高いワクチン効果を示すものが複数存在することに着目し、ワクチン効果を示さないがん細胞株との比較解析を行うことで、ワクチンが効くメカニズムの解明に取り組みました。 その結果、ワクチン効果のあるがん細胞株では、自然免疫系に関係する複数の遺伝子の発現が高くなっていることが分かりました。そこで、発現の高い特定の3つの遺伝子をワクチン効果のないがん細胞株に導入してワクチン療法を行うと、治療効果が得られるようになりました。また、ワクチン効果の発揮にはインターフェロン-γ産生B細胞が重要であることも判明しました。 今回得られた研究成果は、今後のがん細胞ワクチンの開発に貢献するものと期待されます。
なお、本研究成果は、2023年5月22日(月)公開のOncoImmunology誌に掲載されました。
DOI:10.1080/2162402X.2023.2213132
本研究は、学術研究助成基金助成金(#22K19449、#18K07286)、遺伝子病制御研究所 共同利用・共同研究拠点、北海道大学フォトエキサイトニックプロジェクト、GSKジャパン研究助成、特別研究員奨励費(#22J21076)等の支援のもと実施されました。
投稿日:2023-04-13
ドナーB細胞を用いた移植免疫寛容誘導法を開発 ~iPS細胞を用いた移植医療への応用が期待~(免疫生物分野)
免疫生物分野の村田智己氏、清野研一郎教授らの研究グループは、かずさDNA研究所との共同研究により、ドナーのB細胞を用いた移植免疫寛容誘導法を開発しました。
iPS細胞を用いた移植においては、免疫拒絶反応を低減させるために主要組織適合抗原(MHC)を揃えたり、ゲノム編集によってその発現を低下させるなどの工夫が考えられています。一方、研究グループは以前より、MHC以外の抗原(マイナー抗原)による免疫拒絶反応も重要な問題であることを指摘してきました(Murata et al. Sci Rep 10:1, 2020)。今回研究グループは、このマイナー抗原によって拒絶反応が起こる実験系を用い、ドナーの細胞を用いた細胞治療によって拒絶反応を制御できるか検討しました。
移植における拒絶反応を低減させるためにドナーの細胞をレシピエントに投与すること(donor specific transfusion; DST)は以前から行われてきました。しかし、iPS細胞を用いた移植を想定したドナー/レシピエントの組み合わせにおいて、どのようなDSTが最も効果的であるのかは不明でした。研究グループはドナーの脾臓細胞を用いたDSTが有効であることをまず示し、その後脾臓に含まれるどの細胞種が最も有効であるか検討しました。その結果、脾臓由来B細胞が効果的かつ安全に拒絶反応を抑制すること、しかも免疫寛容(免疫抑制剤を投与しなくても移植片が生着し続ける状態)を誘導することを発見しました。ドナーB細胞を用いたDSTによりレシピエントのT細胞にドナーに対する不応答性が誘導され、iPS細胞由来の移植片も生着することが判明しました。
本研究の成果により、今後iPS細胞を用いた移植における効果的かつ安全な免疫制御法が確立されることが期待されます。本研究成果は、2023年4月13日公開のInternational Immunology誌にオンライン掲載されました。また、本研究は遺伝子病制御研究所共同利用・共同研究拠点の支援により行われました。
Murata et al. Induction of allograft tolerance by adoptive transfer of donor B cells: an immune regulatory strategy for transplantation using MHC-matched iPS cells. Int Immunol dxad008, Published: 13 April 2023
DOI:doi.org/10.1093/intimm/dxad008
投稿日:2023-03-31
遺伝要因がピロリ菌感染の胃がんリスクを高めることを解明
-ピロリ菌除菌によりその高まったリスクを低減できる可能性-(感染がん研究センター)
感染癌研究センターの畠山昌則特任教授(微生物研究会微生物化学研究所部長)、理化学研究所生命科学研究センターの碓井喜明特別研究員、桃沢幸秀チームリーダー、愛知県がんセンター研究所がん予防研究分野の松尾恵太郎分野長らの共同研究グループは、特定の遺伝子の病的バリアント保持者ではピロリ菌感染による胃がん発症リスクが高まることを明らかにしました。
共同研究グループは、日本の11,000人以上の胃がん患者群と44,000人以上の非胃がん対称群を用いた世界最大規模の症例対照研究を行い、9個の遺伝子の病的なバリアントが胃がん発症リスクに関連することを発見しました。さらに、これらの病的バリアントとピロリ菌感染情報を組み合わせた解析により、相同組換え修復機構に関わる遺伝子群(ATM、BRCA1、BRCA2、PALB2)の病的バリアント保持者は、非保持者と比較して胃がんリスクへのピロリ菌感染の影響が強くなることを明らかにしました。本研究成果は、胃がんのゲノム医療に貢献することが期待されます。
本研究成果は、2023年3月30日にThe New England Journal of Medicine (IF 176.079)にオンライン掲載されました。
DOI:10.1056/NEJMoa2211807.
投稿日:2023-03-31
がんに対する分子標的薬PARP阻害剤の治療抵抗性のメカニズムを解明
~がん微小環境を標的とした新しい治療法開発に期待~(免疫生物分野)
免疫生物分野の中村貴香氏、梶原ナビール氏、清野研一郎教授らの研究グループは、乳がんや卵巣がんに対して用いられる分子標的薬PARP(poly[ADP]-ribosepolymerase)阻害剤がその効果を発揮するかどうかについて、がん微小環境に存在するサイトカインIL-34が鍵を握っていることを世界で初めて明らかにしました。
一般的に細胞のDNAが損傷されると、PARPやBRCA1/2という分子の働きにより修復されることが知られています。一方、BRCA1/2が機能しない細胞にPARP阻害薬を投与すると、DNA修復機能が2種類とも働かなくなり、その結果「合成致死」と呼ばれる細胞死が誘導されます。この原理をがん細胞へ応用したものがPARP阻害剤であり、分子標的薬と呼ばれる比較的新しい薬剤の一つとなります。PARP阻害剤は非常に効果の高い薬剤である一方、次第に効果が失われてしまう現象(治療抵抗性)が出現するという問題がありました。研究グループは、今回新たに聖マリアンナ医科大学産婦人科学教室(鈴木直教授)との共同研究により、そのメカニズムの一端を解明しました。
研究グループは以前より、がん細胞が産生するサイトカインIL-34が各種治療法にどのような影響を及ぼすか注目してきました。今回、マウスがん細胞を用いた実験で、IL-34を発現する腫瘍ではBRCA1/2が機能しない場合でもPARP阻害剤の効果が見られないことを初めて発見しました。その際の腫瘍内の状態を詳しく調べると、Xcr1というマーカー分子を発現している樹状細胞の数が抑えられ、その結果CD8キラーT細胞が十分に働いていないことが判明しました。この現象は、がん細胞からIL-34を産生しないようにすると解消し、PARP阻害剤の効果も復活することが分かりました。また、臨床の漿液性卵巣がん患者について調べると、IL-34の発現が高い患者群で予後が悪いことも分かりました。以上から、PARP阻害剤の治療効果を高めるには、IL-34あるいは関連分子を標的にした新たな補助療法を加えることが有効であるという新規治療コンセプトが提示されました。
プレスリリースはこちら
本研究成果は、2022年12月21日公開のJournal of Gynecologic Oncology誌にオンライン掲載されました。また、本研究は遺伝子病制御研究所共同利用・共同研究拠点の支援により行われました。
URL:https://ejgo.org/DOIx.php?id=10.3802/jgo.2023.34.e25
投稿日:2022-10-20
IL-34がトリプルネガティブ乳がん腫瘍に及ぼす影響を解明
~新たながん個別化治療コンセプトの確立に期待~(免疫生物分野)
北海道大学大学院医学院博士課程(特別研究員)の梶原ナビール氏、免疫生物分野の清野研一郎教授らの研究グループは、予後不良乳がんとして知られるトリプルネガティブ乳がん(TNBC)において、がん細胞が分泌するインターロイキン-34(IL-34)そのものが予後不良に寄与することを以前に明らかにしており(関連するプレスリリース)、今回新たに、同大学大学院医学院組織細胞学教室、同大学病院乳腺外科、大阪労災病院乳腺外科、同大学医学部分子生物学教室との共同研究により、そのメカニズムの部分を解明しました。

TNBCは乳がん全体の約20%を占め、3年以内の再発率が非常に高く、再発後の生存期間が他のタイプの乳がんに比べ短い乳がんです。また、乳がんの治療で一般的に用いられるホルモン療法や分子標的薬のハーセプチン療法の効果がなく、効果が期待できる薬剤が抗がん剤のみに限られます。そのため、治療に難渋するケースが多く、抗がん剤による副作用に苦しむ患者が多いのが現状です。
本研究では、TNBCの腫瘍組織においてIL-34が強力な免疫抑制と抗がん剤抵抗性を誘導することを発見しました。また、実験用マウスや患者から採取したTNBC腫瘍組織を使った実験により、IL-34の遮断がそれらを解除し、IL-34阻害薬と抗がん剤を組み合わせることで、がん細胞の成長を大幅に遅延させることを明らかにしました。
本結果は、TNBCの予後不良や治療抵抗性とIL-34の関係を示すものであり、IL-34やそれにより誘導される免疫抑制細胞を標的とした新規治療コンセプトの確立に繋がるものと期待されます。
なお、本研究成果は、2022年9月14日(水)公開のCancer Immunology, Immunotherapy誌にオンライン掲載されました。
論文名:Tumor-derived interleukin-34 creates an immunosuppressive and chemoresistant tumor microenvironment by modulating myeloid-derived suppressor cells in triple-negative breast cancer(腫瘍由来インターロイキン-34はトリプルネガティブ乳がんにおいて骨髄由来抑制細胞を調節することで免疫抑制性及び化学療法抵抗性の腫瘍環境を構築する)
URL:https://doi.org/10.1007/s00262-022-03293-3
プレスリリースはこちら
投稿日:2022-10-13
慢性心不全心筋エネルギー産生能低下をもたらす代謝変化の同定にはじめて成功 ~慢性心不全治療への貢献に期待~
北海道大学の佐邊壽孝名誉教授(前大学院医学研究院教授、現遺伝子制御病研究所客員教授)、北海道大学医学研究院の高田真吾研究員(現北翔大学准教授)、九州大学大学院医学研究院の絹川真太郎准教授らの共同研究グループは、マウスモデルを用い、慢性心不全における心筋ミトコンドリアエネルギー産生能低下の主原因となる代謝変化を捉えることに世界ではじめて成功しました。
変化を補完する代謝物の投与によって、心不全での心筋ミトコンドリアのエネルギー産生能低下、心機能と全身運動能を統計的有意に補完し得ること、マウス生存性も延長されることを実験実証しました。慢性心不全マウスで見つかった代謝変化と同等と考えられる変化はヒトdatabaseでも確認されます。今回の研究成果は、特定の栄養素を基盤とする「より自然な」慢性心不全治療薬開発に対し、基礎医学的妥当性を与えるものです。

本研究成果は、米国時間2022年10月3日(月曜)公開の米国アカデミー紀要誌に掲載されました。
論文名:Succinyl-CoA-based energy metabolism dysfunction in chronic heart failure(慢性心不全におけるサクシニルCoAベースのエネルギー代謝機能障害)
URL:https://doi.org/10.1073/pnas.2203628119
プレスリリースはこちら
投稿日:2022-07-12
慢性ストレスで自己免疫疾患が増悪する分子機構を発見
~難治性疾患である精神神経ループスに対する新規治療開発に期待~(分子神経免疫学分野)
分子神経免疫学分野・村上正晃教授らの研究グループは、大学院医学研究院免疫・代謝内科学教室(渥美達也教授)と共同研究で、正常マウスでは、単独で病態を誘導しない睡眠不足による慢性ストレスが、全身性エリテマトーデス(SLE)モデルマウスにて、大脳特定神経核のミクログリア活性化を介した神経の異常活性化の影響で異常行動を伴う重症化を引き起こす分子機構を解明しました。

- 慢性ストレスにより全身性エリテマトーデスにおける精神変容が引き起こされる分子機構を発見。
- 慢性ストレスで前頭皮質神経のミクログリアが活性化し、サイトカインを介した神経活性化を誘導。
- 中枢神経系におけるサイトカイン制御によって、精神神経ループスへの新規治療開発に期待。
本研究成果は、日本時間2022年7月11日(月)公開の Annals of the Rheumatic Diseases誌にオンライン掲載されました。
URL:https://ard.bmj.com/content/early/2022/07/06/ard-2022-222566
プレスリリースはこちら
【報道】
- 北海道新聞・北海道新聞電子版 に掲載されました。(2022.7.12)
- EurekAlert・ AlphaGalileo・ Asia Research News. に掲載されました。(2022.7.12)
- Tii 生命科学 に掲載されました。(2022.7.12)
- GEN News に掲載されました。(2022.7.13)
- 北海道医療新聞 に掲載されました。(2022.7.25)
投稿日:2022-05-18
世界初!神経回路で遠隔部位に炎症を生む分子機構を発見(分子神経免疫学分野)
北海道大学遺伝子病制御研究所,量子科学技術研究開発機構量子生命科学研究所,自然科学研究機構生理学研究所の村上正晃教授らの研究グループは,複数の関節リウマチモデルを用いて,炎症性疾患で遠隔部位に左右対称な炎症病変を生じさせる分子機構を明らかにし,これを「遠隔炎症ゲートウェイ反射」と定義しました。

- 関節内の炎症を,特定の神経回路を介して逆側の関節内に伝播させる分子機構を発見。
- その分子機構は炎症で生じるATPにより活性化し,かつ逆側関節での ATP産生から炎症を誘導。
- 本神経回路,ATPの人為的制御による関節リウマチ,間質性肺炎,乾 癬などの治療への応用に期待。
本研究成果は、Journal of Experimental Medicine(2022.5.17公開)に掲載されました。
URL:https://doi.org/10.1084/jem.20212019
【報道】
・日本経済新聞オンライン
・どうしん電子版
投稿日:2022-04-08
iPS 細胞ストックを用いた移植のための新規免疫抑制法を提案
~他家 iPS 細胞由来組織を用いた移植医療への貢献に期待~(免疫生物分野)
免疫生物分野の鎌谷智紀(修士1年)、清野研一郎教授らの研究グループは、MHC型一致他家マウス皮膚移植モデルを用いて日本で使用が計画されているiPS細胞ストックの使用に際して生じうる拒絶反応の制御方法を検討し、制御に有効な免疫抑制法を初めて提案しました。
投稿日:2022-03-25
シェーグレン症候群の新たな病態生理を解明
野口昌幸客員教授は遺制研在任中より米国NIHのJohn Chiorini博士と国際共同研究を続けてきましたが、この度シェーグレン症候群の新たな病態生理を解明し、The Journal of Clinical Investigation誌に発表しました。

シェーグレン症候群は口腔内の乾燥感を主徴とした自己免疫性の唾液腺炎で、いまだ詳しい病因が分かっておらず根本的治療法もないため、患者さんは慢性的な乾燥症状や口腔機能の低下に苛まれてきました。当研究グループでは、このシェーグレン症候群の病態生理を明らかとし、疾患特異的な治療アプローチを開発することを目的に研究を進めて参りましたが、今回本疾患が誘導されるメカニズムを新たに解明しました。
https://pubmed.ncbi.nlm.nih.gov/35113815/
投稿日:2021-11-12
サイトカインIL-34の生理的・病理的意義に関する総説論文を発表
免疫生物分野の大塚亮助教、和田はるか准教授、清野研一郎教授らのグループは、サイトカインIL-34の生理的・病理的意義に関する最新の知見を基に総説論文を発表しました。
インターロイキン−34(IL-34)は、その受容体をコロニー刺激因子-1(CSF-1)と共有するサイトカインとして2008年に同定されました。IL-34の発見によって、CSF-1からのみシグナルを受け取ると考えられてきたCSF-1受容体を介した新たな生理現象の存在が示唆されました。
IL-34の発現は通常では特定の組織に限局していますが、いくつかの病的状態ではその発現が上昇することが報告されています。特にがんでは、IL-34はがん細胞によって産生され、がんの治療抵抗性と進行に寄与することが近年報告されました。一方、IL-34の発現は、一部の脳および皮膚の疾患では低下することも知られています。
本総説論文では、IL-34とCSF-1との類似性や相違性に基づいて、IL-34の生理的および病理的役割を包括的に解説し、IL-34と疾患との関わりについても論じました。
本総説論文は、2021年11月11日(木)公開の Seminars in Immunology誌の特別号 ”The regulation of the immune system by CSFs in the steady state and pathology” (Guest editors: Prof. John Hamilton and Prof. Adrian Achuthan) にオンライン掲載されました。
https://www.sciencedirect.com/science/article/pii/S1044532321000488?via%3Dihub
投稿日:2021-05-12
新型コロナウイルスに対する感染防御の新しい知見の論文発表(分子生体防御分野)
分子生体防御分野の高岡晃教教授、山田大翔助教らのグループが、北大、人獣共通感染症リサーチセンターの澤先生らのグループと共同研究を行い、その成果が、5月11日18時付けで米国の免疫学雑誌のNature Immunologyに公表されることが決定いたしました。
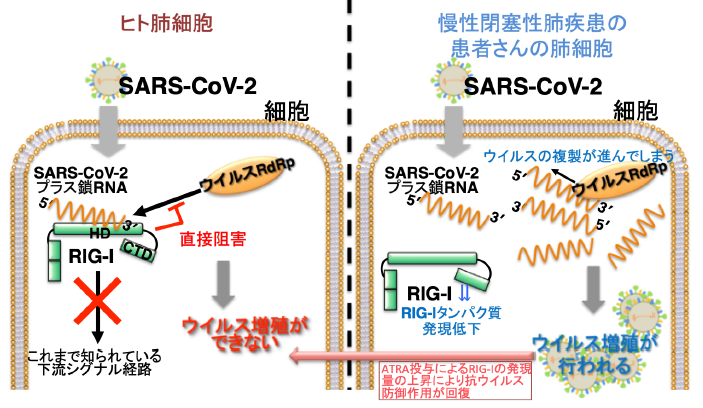
当グループはCOVID-19の原因となっているSARS-CoV-2に対する自然免疫のしくみに関する基礎的な研究を行い、 SARS-CoV-2のウイルスセンサー分子を同定し、それによる新しい感染防御の仕組みを明らかにしました。
今回の結果は COVID-19の予防や治療、あるいは重症化の予測という観点から重要な切り口になる可能性を提示しました。
投稿日:2021-04-22
難治性乳がん・膵がんに有効な革新的核酸医薬候補の開発に成功(分子生体防御分野)
今井浩三客員教授のグループが、以前から東大医科研で実施しておりました研究が、Int J Cancer にアクセプトされ臨床治験が始まりましたので、医科研から記者発表いたしました。
https://pubmed.ncbi.nlm.nih.gov/33783816/
投稿日:2021-01-18
腫瘍の多様性と可塑性における癌幹細胞の働きに関する総説論文を発表
幹細胞生物学分野の近藤亨教授は、腫瘍の多様性と可塑性について、癌幹細胞の知見を基に考察した総説論文を発表しました。
腫瘍は癌細胞と多様な正常細胞から構成されていることが病理観察から明らかにされていましたが、腫瘍発生に関わる様々な遺伝子・エピジェネテック変異の同定、癌幹細胞を頂点とした癌細胞ヒエラルキーの存在とその可塑性の発見、腫瘍微小環境における癌(幹)細胞と正常細胞のコミュニケーションに関わる研究、最新の細胞・組織培養法や解析技術の開発により、腫瘍が考えられていた以上に複雑な組織を構成していることが明らかにされ始めています。更に、この腫瘍の複雑さが治療抵抗性に関与していると推測され、その解明が癌根治に必要不可欠と考えられています。
本総説論文では、脳腫瘍幹細胞をモデルとして癌幹細胞の起源細胞と遺伝子変異の組み合わせによる癌幹細胞の多様性や可塑性を論じるとともに、癌幹細胞とその周辺細胞間のコミュニケーションに関わる最新の知見や単一細胞解析による癌幹細胞の性状解析の有効性と欠点について論じ、現時点で可能な癌幹細胞を標的とした新規治療法を生み出す方法論を利用した最新の研究成果についても言及しました。
本総説論文は、2021年1月14日(木)公開の Seminars in Cancer Biology誌のテーマ課題 ”Cancer Cell Heterogeneity and Plasticity: From Molecular Understanding to Therapeutic Targeting”(Guest editors: Prof. Dean G. Tang, Prof. Toru Kondo)にオンライン掲載されました。
https://doi.org/10.1016/j.semcancer.2021.10.001
投稿日:2020-12-04
ショウジョウバエを用いたがん研究に関する総説論文を発表(がん制御学分野)
がん制御学分野の山村凌大博士研究員、大塩貴子助教、園下将大教授は、ショウジョウバエの活用によって明らかになった腫瘍形成機構や様々ながん遺伝子型モデルハエの紹介、そしてそれらのハエを用いた最新の創薬研究について概説した総説論文を発表しました。(論文タイトル:Tiny Drosophila makes giant strides in cancer research.)
がんの疾病負荷は年々世界的に増加しており、世界の全死因の第2位となっています。過去数十年にわたり、培養がん細胞や遺伝子改変マウスなどの実験モデルが、がん研究の発展に大きく貢献してきました。最近では、これらの伝統的な実験系に加えて、ゼブラフィッシュ、線虫、ショウジョウバエなどが、がん研究を加速させる新たな実験動物として注目されています。このうちハエは、遺伝学的実験が容易で、安価・迅速に研究を実施できるなど、哺乳類を補完する多数の利点を備えています。私たちは最近さらに、ハエが哺乳類と類似した形質転換機序や薬物応答を示すことも見出し、個体レベルでの新規治療標的の同定や治療薬候補の同定にハエが大変有用な実験動物であることを示しました。
本総説論文では、これらを含めこれまでにハエががん研究分野で成し遂げた貢献について、遺伝子組換えハエの作出や薬物スクリーニングなどの具体例を挙げながら解説しています。

図:ショウジョウバエを用いた腫瘍形成機構の解明と新規がん治療法の開発
形質転換を起こす突然変異体の解析により、腫瘍の形成に関わる多数の遺伝子が同定された(①)。
一方、がん患者の遺伝子型を模倣した様々なモデルハエの作出が進んでおり(②)、それらを用いた個体レベルの薬物スクリーニングや化合物最適化によって、新たながん治療薬の候補が次々と誕生している(③)。
本総説論文は、2020年12月4日公開のCancer Science誌にオンライン掲載されました。
DOI:https://doi.org/10.1111/cas.14747
投稿日:2020-08-07
新型コロナウイルス感染症にともなうマクロファージ活性化症候群に関する総説論文を発表(免疫生物分野)
免疫生物分野の大塚助教,清野教授らの研究グループは,新型コロナウイルス(SARS-CoV-2*1)感染患者でみられる強い炎症状態について,最新の知見をまとめた総説論文を発表しました。
SARS-CoV-2 ウイルスは急速に全世界的に広がり,パンデミック状態にあります。明確な治療薬やワクチン開発は未だ開発途上にあるため, 私達の生命をおびやかすこの新興感染症の収束の兆しは未だにみえていません。SARS-CoV-2 感染症(COVID-19)患者の一部は症状が重篤化し,命を落とす危険性があります。このような重度の COVID-19 では, 血液中の炎症性サイトカインの濃度が非常に高い状態(サイトカインストーム)にあることが明らかになってきました。この特徴は自己免疫疾患などにともなって発症する, マクロファージ 活性化症候群で見られる高サイトカイン血症に類似しています。
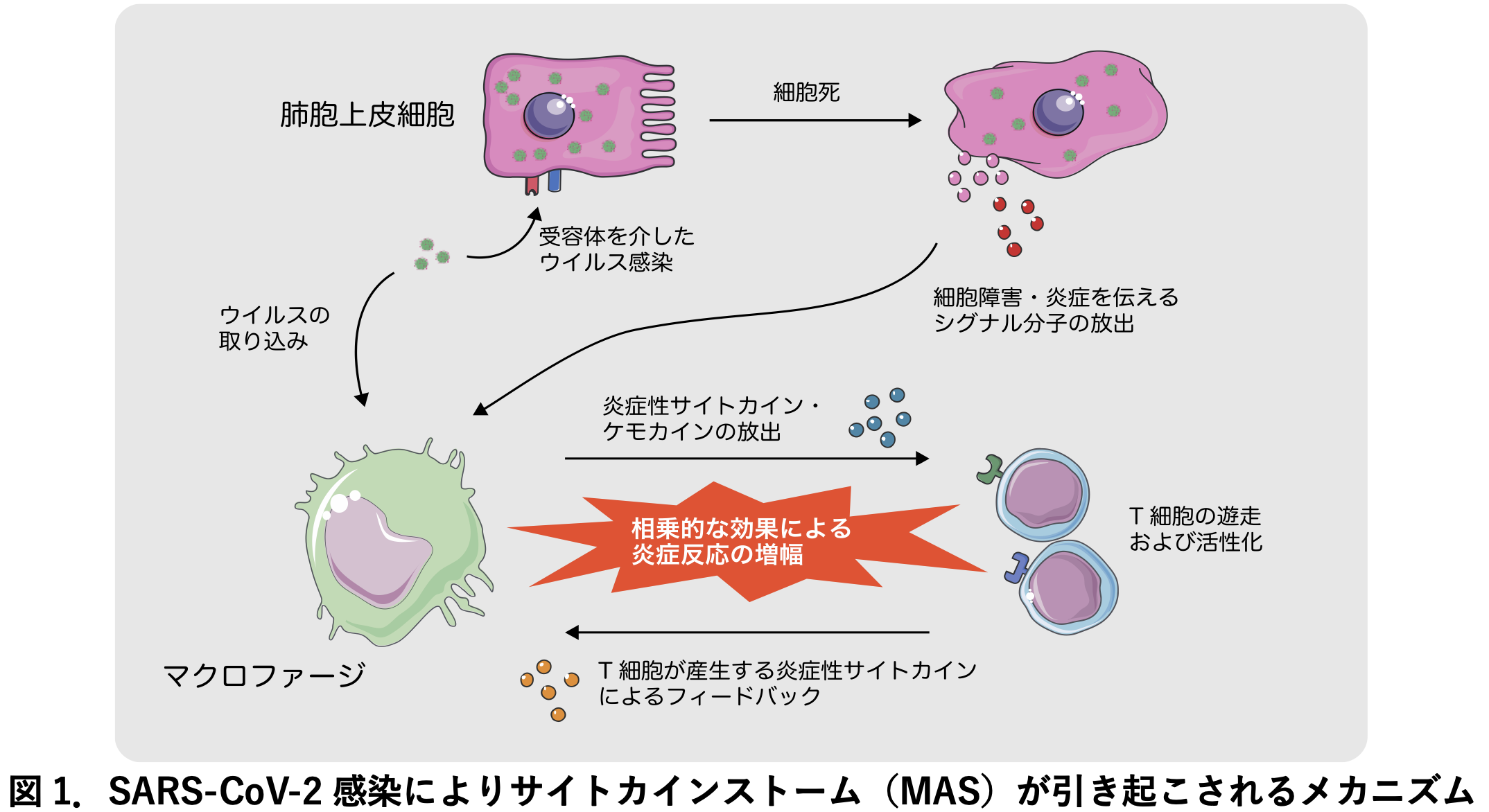
さらに,SARS-CoV-2 ウイルスの感染は肺全体で強い急性炎症を引き起こし,急性呼吸窮迫症候群とよばれる症状を引き起こします。呼吸器で発生したこの症状は,重篤な場合には全身性のサイトカインストームにいたり,血管内凝固症候群や,最終的には全身臓器の機能不全を引き起こし,死にいたります。このように血液中に高濃度の炎症性サイトカインが検出される状態に対しては,抗体などを利用した抗サイトカイン療法が効果的であることが過去に報告されています。
投稿日:2020-04-28
新型コロナウイルスがどのように致死性のCOVID-19を誘導するかの考察論文を発表
村上教授と量子技術研究開発機構の平野敏夫理事長は、新型コロナウイルスがどのように致死性の COVID-19 を誘導するかの考察論が「Immunity」に掲載されました。
研究グループは,新型コロナウイルス感染症(COVID-19*1)で生じる急性呼吸器不全症候群(ARDS:Acute Respiratory Distress Syndrome)がサイトカインストームにより発症するサイトカインリリース症候群(CRS: Cytokine Release Syndrome)*3 である可能性と,それを防ぐ治療標的としてIL-6-STAT3 経路を提唱しました。
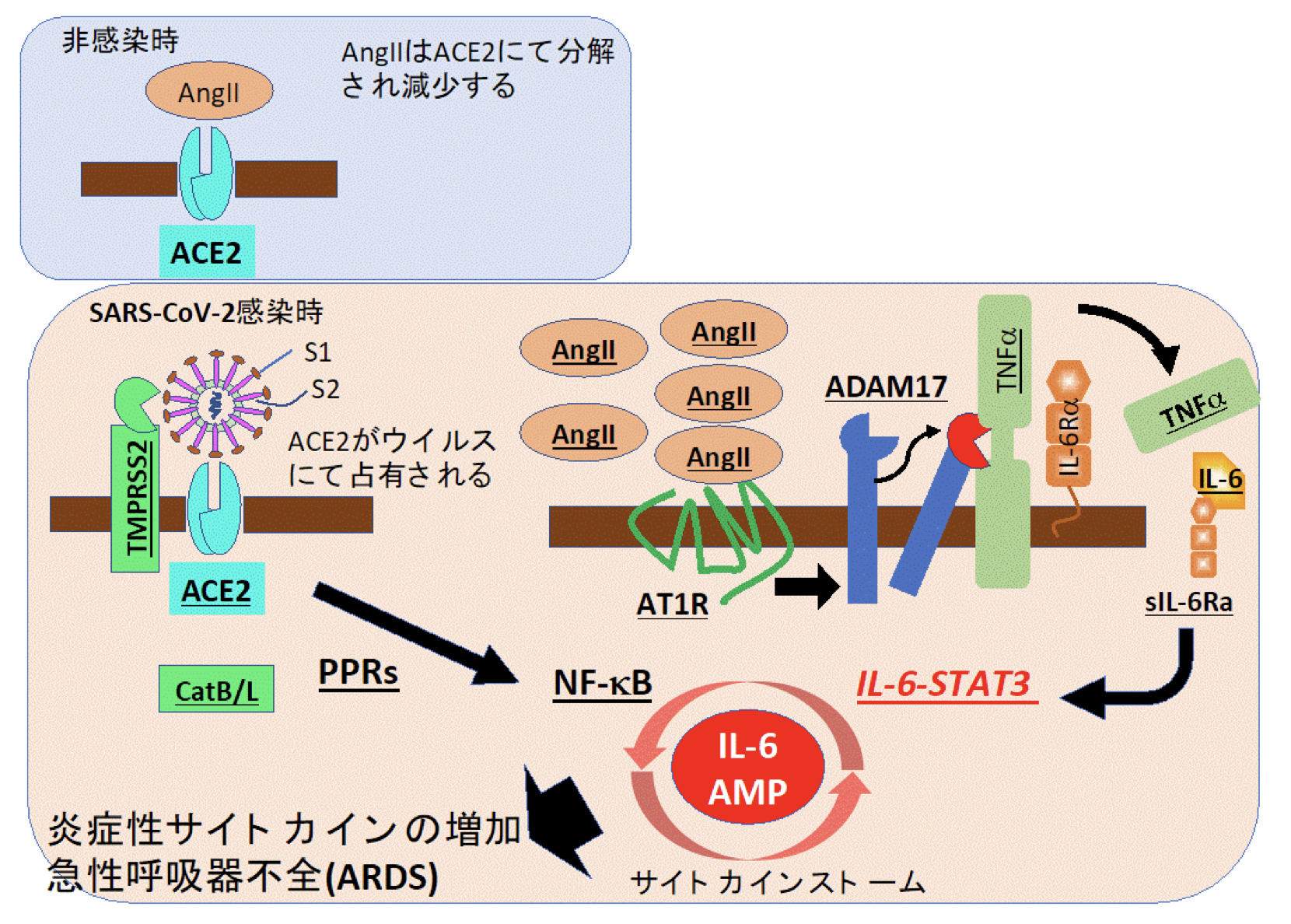
図.SARS-CoV-2 感染時に,気管支・肺胞上皮細胞での IL-6 アンプが活性化し,その後の過剰なサイトカイン産生と急性呼吸器不全症候群(ARDS)を誘導する模式図
