投稿日:2025-06-30
すい管腺がん細胞の細胞死を誘導する新たな手法を発見 〜難治性がんに対する新たな治療法開発の加速に期待〜(がん制御学分野)
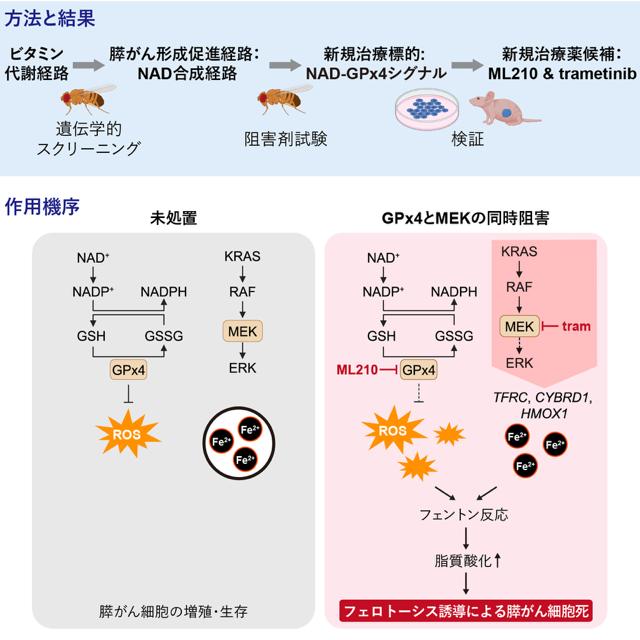
がん制御学分野の園下将大教授、株式会社フライワークスらの研究グループは、すい臓に発生するがんの大部分を占めるすい管腺がん(PDAC)の新たな代謝的脆弱性としてニコチンアミドアデニンジヌクレオチド(NAD)合成経路を同定しました。
さらに、NAD合成経路の下流で機能するGPx4が、PDACの治療標的であることを見出しました。特に、GPx4阻害剤ML210とMEK阻害剤trametinibを併用することで、ヒトPDAC細胞の細胞死(フェロトーシス)を誘導してPDAC形成を抑制できることを発見し、この組み合わせ療法がPDACに対する有望な治療戦略となる可能性を示しました。
PDACは、すい臓がんの一種で、5年生存率がわずか10%という極めて予後不良ながんとして知られています。また、治療法の選択肢が極めて限られている代表的な難治がんの一つであり、高齢化の進行や生活習慣の変化などにより罹患者数の増加が予想されています。そのため、新たな治療標的の同定や治療薬の開発は、喫緊の福祉課題とされています。
研究グループはこれまでの研究成果から、治療の鍵は、体内の代謝やエネルギー産生などに必要不可欠なビタミンB群にあると考えました。ビタミンB群は食物に含まれる身近な栄養素ですが、これらがPDACの発生や進展において果たす役割は十分に解明されていません。
そこで研究グループは、ヒトPDACの遺伝子変異パターンを模倣したモデルショウジョウバエを用いて、それらの代謝を抑制した際の影響を解析しました。その結果、特にビタミンB3の代謝経路が駆動するNAD合成経路を阻害することで、このモデルハエの生存性が上昇すること、そして活性酸素種(ROS)を除去する活性を有するGPx4がこの経路における重要なエフェクターであることが分かりました。
さらに、GPx4及びMEKの同時阻害は、ヒトPDAC細胞を移植したモデルマウスにおいて、ROS蓄積を介したフェロトーシスを誘導し、腫瘍の成長を抑制しました。本研究成果は、フェロトーシス誘導を介したPDACの新規治療法の開発に貢献すると期待されます。
なお、本研究成果は、2025年5月30日(金)公開のMolecular Therapy誌にオンライン掲載されました。
【論文名】
Inhibition of NAD-GPx4 axis and MEK triggers ferroptosis to suppress pancreatic ductal adenocarcinoma (NAD–GPx4 シグナルとMEK の同時阻害は、フェロトーシスを誘導してすい管腺がんの形成を抑制する)
【雑誌名】
Molecular Therapy(分子標的療法の専門誌)
DOI: 10.1016/j.ymthe.2025.05.037
